题目内容
某化学兴趣小组欲通过实验测定某种石灰石中碳酸钙的质量分数.取该石灰石样品8.0g,将100mL稀盐酸分四次加入,所得数据如下表(已知该石灰石中的杂质不溶于水,也不与稀盐酸反应):
| 序号 | 加入稀盐酸的体积(mL) | 充分反应后剩余固体的质量(g) |
| 1 | 25 | 5.5 |
| 2 | 25 | m |
| 3 | 25 | 1.2 |
| 4 | 25 | n |
(2)该石灰石中碳酸钙的质量分数为________.
(3)若要制取6.6g二氧化碳,至少需要该石灰石多少克?(请写出详细的计算过程,结果保留一位小数)
解:(1)第一次加入25mL的盐酸,剩余固体的质量为5.5g,固体质量减少8g-5.5g=2.5g;说明25mL盐酸完全反应可反应2.5g碳酸钙,故第二次剩余固体的质量应为5.5g-2.5g=3.0g;第三次加入25mL盐酸,剩余固体的质量只减少3g-1.2g=1.8g,说明碳酸钙全部参加反应,因此第四次加入盐酸后,剩余固体质量不变.
故答案为:3.0 1.2
(2)该石灰石中碳酸钙的质量分数为: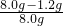 ×100%=85%
×100%=85%
故答案为:85%
(3)解:设至少需要碳酸钙的质量为x.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 6.6g
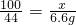
x=15.0g
需要石灰石的质量为:15.0g÷85%═17.6g
答:至少需要该石灰石17.6g.
分析:(1)根据第一次加入25mL的盐酸,剩余固体的质量为5.5g,固体质量减少8g-5.5g=2.5g;说明25mL盐酸完全反应可反应2.5g碳酸钙,故第二次剩余固体的质量应为5.5g-2.5g=3g但是第三次加入25mL盐酸,剩余固体的质量只减少3g-1.2g=1.8g,说明碳酸钙全部参加反应,因此第四次加入盐酸后,剩余固体质量不变.
(2)利用剩余杂质固体的质量,可求出碳酸钙的质量,碳酸钙的质量与石灰石样品质量百分比求得石灰石中碳酸钙的质量分数.
(3)利用化学方程式把二氧化碳的质量代入方程式求出碳酸钙的质量,再利用碳酸钙的质量和石灰石中碳酸钙的质量分数,即可求解.
点评:把握住记录数据中在发生着变化的数据,分析数据变化的原因或变化的规律,这是分析实验数据的一种常用方法,也是这类题的解题关键.
故答案为:3.0 1.2
(2)该石灰石中碳酸钙的质量分数为:
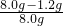 ×100%=85%
×100%=85%故答案为:85%
(3)解:设至少需要碳酸钙的质量为x.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 6.6g
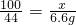
x=15.0g
需要石灰石的质量为:15.0g÷85%═17.6g
答:至少需要该石灰石17.6g.
分析:(1)根据第一次加入25mL的盐酸,剩余固体的质量为5.5g,固体质量减少8g-5.5g=2.5g;说明25mL盐酸完全反应可反应2.5g碳酸钙,故第二次剩余固体的质量应为5.5g-2.5g=3g但是第三次加入25mL盐酸,剩余固体的质量只减少3g-1.2g=1.8g,说明碳酸钙全部参加反应,因此第四次加入盐酸后,剩余固体质量不变.
(2)利用剩余杂质固体的质量,可求出碳酸钙的质量,碳酸钙的质量与石灰石样品质量百分比求得石灰石中碳酸钙的质量分数.
(3)利用化学方程式把二氧化碳的质量代入方程式求出碳酸钙的质量,再利用碳酸钙的质量和石灰石中碳酸钙的质量分数,即可求解.
点评:把握住记录数据中在发生着变化的数据,分析数据变化的原因或变化的规律,这是分析实验数据的一种常用方法,也是这类题的解题关键.

练习册系列答案
相关题目
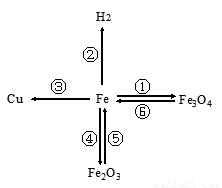
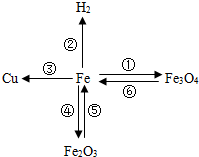 构建知识网络是一种重要的学习方法.如图是有关铁的性质和获得的网络图.
构建知识网络是一种重要的学习方法.如图是有关铁的性质和获得的网络图. ”均为铜片),只需完成实验
”均为铜片),只需完成实验
 ”均为铜片),只需完成实验 和 即可达到探究目的(选填字母)。
”均为铜片),只需完成实验 和 即可达到探究目的(选填字母)。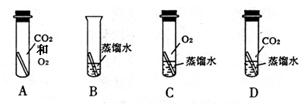
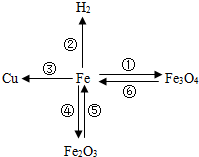 构建知识网络是一种重要的学习方法.如图是有关铁的性质和获得的网络图.
构建知识网络是一种重要的学习方法.如图是有关铁的性质和获得的网络图. ”均为铜片),只需完成实验______和______即可达到探究目的(选填字母).
”均为铜片),只需完成实验______和______即可达到探究目的(选填字母).