题目内容
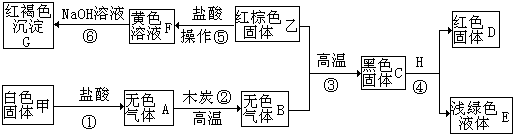
某不纯的碳酸钠固体样品,含有的杂质可能是Na2SO4、CaCO3、CuSO4、NaCl四种物质中的一种或几种.为确定其杂质的成分,进行如图实验:
试根据实验过程和发生的现象填写以下空白:
(1)常温下,气体C的水溶液的pH 7(填“大于”“小于”“等于”之一).
(2)操作Ⅰ的名称是 .
(3)根据上述实验,证明可能混入的四种物质中,一定不存在的物质是 .
(4)根据上述实验,已经证明了溶液B中存在的溶质有(写化学式) .
(5)仅根据上述实验现象,Na2SO4、CaCO3、CuSO4、NaCl四种物质中,还不能确定是否混入Na2CO3样品中的物质是 (写化学式).
(6)要进一步推理固体样品中的物质,可用溶液B再实验,请简要说明实验操作步骤、发生的现象及结论 .

试根据实验过程和发生的现象填写以下空白:
(1)常温下,气体C的水溶液的pH
(2)操作Ⅰ的名称是
(3)根据上述实验,证明可能混入的四种物质中,一定不存在的物质是
(4)根据上述实验,已经证明了溶液B中存在的溶质有(写化学式)
(5)仅根据上述实验现象,Na2SO4、CaCO3、CuSO4、NaCl四种物质中,还不能确定是否混入Na2CO3样品中的物质是
(6)要进一步推理固体样品中的物质,可用溶液B再实验,请简要说明实验操作步骤、发生的现象及结论
考点:实验探究物质的组成成分以及含量,过滤的原理、方法及其应用,溶液的酸碱性与pH值的关系,盐的化学性质
专题:科学探究
分析:根据题干提供的信息进行分析,样品加水得无色溶液,硫酸铜的水溶液是蓝色的,碳酸钙不溶解于水,因此一定不含有硫酸铜、碳酸钙;加入硝酸钡溶液产生了沉淀A,由于碳酸钠能与氯化钡反应生成碳酸钡沉淀,硫酸钠能与氯化钡反应生成硫酸钡沉淀,加入稀硝酸得到了无色气体D,则D是二氧化碳,白色沉淀F是硫酸钡,在滤液C中加入硝酸银溶液,若生成了不溶于稀硝酸的白色沉淀G,则G是氯化银,说明B中含有氯离子,此步骤是想证明杂质中含有氯化钠,据此解答即可.
解答:解:样品加水得无色溶液,硫酸铜的水溶液是蓝色的,碳酸钙不溶解于水,则一定不含有硫酸铜,碳酸钙;加入硝酸钡溶液产生了沉淀A,由于碳酸钠能与氯化钡反应生成碳酸钡沉淀,硫酸钠能与氯化钡反应生成硫酸钡沉淀,加入稀硝酸得到了无色气体D,则D是二氧化碳,白色沉淀F是硫酸钡,故杂质中一定含有硫酸钠;在滤液B中加入硝酸银溶液,若生成了不溶于稀硝酸的白色沉淀,则沉淀是氯化银,说明B中含有氯离子,此步骤可证明含有氯化钠;
(1)C是二氧化碳,二氧化碳溶于水生成碳酸,碳酸呈酸性,pH值小于7;故填:小于;
(2)操作Ⅰ的名称是过滤;故填:过滤
(3)碳酸钠样品中一定不含有硫酸铜和碳酸钙钙,故填:CuSO4、CaCO3;
(4)碳酸钠样品中一定含有硫酸钠,故填:Na2SO4;
(5)碳酸钠样品中不能确定存在的物质是氯化钠,故填:NaCl;
(6)若要检验NaCl是否存在,可以在B溶液中加入适量硝酸银溶液和稀硝酸,若有白色沉淀,则说明含有氯化钠,故填:向B溶液中加入适量硝酸银溶液和稀硝酸,若有白色沉淀,则说明含有氯化钠.
(1)C是二氧化碳,二氧化碳溶于水生成碳酸,碳酸呈酸性,pH值小于7;故填:小于;
(2)操作Ⅰ的名称是过滤;故填:过滤
(3)碳酸钠样品中一定不含有硫酸铜和碳酸钙钙,故填:CuSO4、CaCO3;
(4)碳酸钠样品中一定含有硫酸钠,故填:Na2SO4;
(5)碳酸钠样品中不能确定存在的物质是氯化钠,故填:NaCl;
(6)若要检验NaCl是否存在,可以在B溶液中加入适量硝酸银溶液和稀硝酸,若有白色沉淀,则说明含有氯化钠,故填:向B溶液中加入适量硝酸银溶液和稀硝酸,若有白色沉淀,则说明含有氯化钠.
点评:本题考查了混合物成分的推断,完成此题,可以依据物质的性质结合物质间反应的实验现象进行.要求同学们加强对基础知识的储备,以便灵活应用.

练习册系列答案
相关题目
下列所描述的现象,从化学的角度理解不正确的是( )
| A、花香四溢:分子在不断运动 |
| B、热胀冷缩:分子的大小发生了变化 |
| C、干冰升华:分子本身没有发生变化 |
| D、火要空心:增加可燃物与空气的接触面积 |
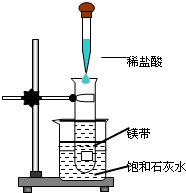 如图所示,把试管放入盛有25°C时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列问题:
如图所示,把试管放入盛有25°C时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列问题:
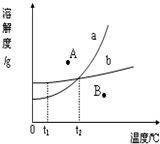 如图是某实验小组的同学绘制的两种固体物质的溶解度曲线图.请你根据图示回答问题:
如图是某实验小组的同学绘制的两种固体物质的溶解度曲线图.请你根据图示回答问题: