题目内容
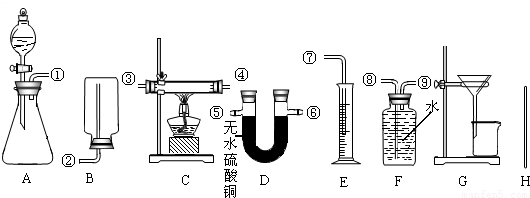
根据下列所给出的药品、实验装置和实验中可测得的数据,设计实验来粗略测定由铜和锌两种金属组成的合金a g中锌的质量分数(合金已加工成粉末).
药品:足量的浓硫酸、足量的稀硫酸、足量的稀硝酸和氧化铜.
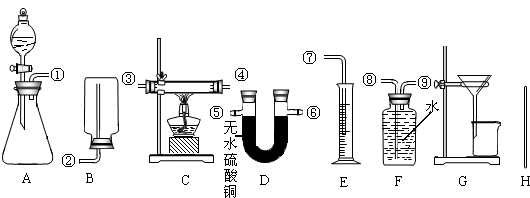
在实验中可测得的数据:
充分反应后,生成氢气的体积为bL(在此条件下,2.0gH2的体积是22.4L),反应前仪器和药品的质量为c g,充分反应后剩余固体的质量为d g,充分反应后仪器和药品的质量为e g.请你设计三个方案填入下表中:
| 选用药品的名称(1) | 选用的实验装置及组装时接口的连接顺序(2) | 需测得的实验数据(从上述可测得的数据中选取)(3) | 合金中锌的质量分数的计算式(4) | ||
| 选用的实验装置序号 | 组装时接口编号的连接顺序(如不需要组装,则不填) | ||||
| 方案一 | |||||
| 方案二 | |||||
| 方案三 | |||||
解:方案一:利用药品稀硫酸与铜、锌合金中的锌反应,反应完毕后利用过滤操作,将不参加反应的铜分离出来,用合金总质量a g-剩余固体的质量为d g,锌的质量,再利用 ×100%;
×100%;
方案二:利用药品稀硫酸与铜、锌合金中的锌反应,产生的氢气通过FE装置测出氢气的体积为bL,再利用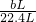 ×2.0g=
×2.0g=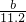 g算出氢气质量,再根据方程式由氢气质量算出锌的质量,设参加反应的锌的质量为X:
g算出氢气质量,再根据方程式由氢气质量算出锌的质量,设参加反应的锌的质量为X:
Zn+H2SO4═ZnSO4+H2↑
65 2
X
根据比例式: ,解得X=
,解得X=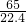
所以锌的质量分数为: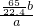 ×100%;
×100%;
方案三:利用药品稀硫酸与铜、锌合金中的锌反应,产生氢气,再利用仪器和药品的质量的减少量就是生成氢气的质量,所以生成氢气的质量:eg-cg,设参加反应的锌的质量为Y:
Zn+H2SO4═ZnSO4+H2↑
65 2
Y cg-eg
根据比例式:
解得Y=32.5(c-e)g,
所以锌的质量分数为: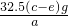 ×100%.
×100%.
故答案为:方案一:稀硫酸;AG;合金总质量a g和剩余固体的质量为d g; ×100%;
×100%;
方案二:稀硫酸;AFE;①⑨⑧⑦;测出氢气的体积为bL;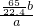 ×100%;
×100%;
方案三:稀硫酸;A;称量出反应前仪器和药品的质量为c g,充分反应后仪器和药品的质量为e g;为: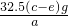 ×100%.
×100%.
分析:根据铜和锌两种金属组成的合金中锌和硫酸能反应,铜和硫酸不反应,反应完了将溶液过滤得到的是铜,用合金的质量减去铜的质量,就是锌的质量,再除以合金的总质量即可;也可以根据锌与硫酸反应产生氢气,利用氢气排水的方法测出氢气的体积,再换算出质量,根据氢气的质量算出锌的质量,再利用锌的质量除以合金的总质量乘以百分之百;还有一种方法是利用锌与硫酸反应产生氢气,根据仪器和药品的质量的减少量就是生成氢气的质量,进而算出锌的质量,再利用锌的质量除以合金的总质量乘以百分之百.
点评:本题主要是利用锌与硫酸反应,铜与硫酸不反应,可以根据反应前后仪器和药品的质量的减少量就是氢气的质量,去算锌的质量,也可以利用氢气排水的方法算出氢气的体积,再换算成质量进行计算.
 ×100%;
×100%;方案二:利用药品稀硫酸与铜、锌合金中的锌反应,产生的氢气通过FE装置测出氢气的体积为bL,再利用
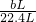 ×2.0g=
×2.0g=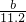 g算出氢气质量,再根据方程式由氢气质量算出锌的质量,设参加反应的锌的质量为X:
g算出氢气质量,再根据方程式由氢气质量算出锌的质量,设参加反应的锌的质量为X:Zn+H2SO4═ZnSO4+H2↑
65 2
X

根据比例式:
 ,解得X=
,解得X=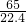
所以锌的质量分数为:
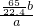 ×100%;
×100%;方案三:利用药品稀硫酸与铜、锌合金中的锌反应,产生氢气,再利用仪器和药品的质量的减少量就是生成氢气的质量,所以生成氢气的质量:eg-cg,设参加反应的锌的质量为Y:
Zn+H2SO4═ZnSO4+H2↑
65 2
Y cg-eg
根据比例式:
解得Y=32.5(c-e)g,
所以锌的质量分数为:
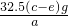 ×100%.
×100%.故答案为:方案一:稀硫酸;AG;合金总质量a g和剩余固体的质量为d g;
 ×100%;
×100%;方案二:稀硫酸;AFE;①⑨⑧⑦;测出氢气的体积为bL;
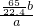 ×100%;
×100%;方案三:稀硫酸;A;称量出反应前仪器和药品的质量为c g,充分反应后仪器和药品的质量为e g;为:
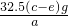 ×100%.
×100%.分析:根据铜和锌两种金属组成的合金中锌和硫酸能反应,铜和硫酸不反应,反应完了将溶液过滤得到的是铜,用合金的质量减去铜的质量,就是锌的质量,再除以合金的总质量即可;也可以根据锌与硫酸反应产生氢气,利用氢气排水的方法测出氢气的体积,再换算出质量,根据氢气的质量算出锌的质量,再利用锌的质量除以合金的总质量乘以百分之百;还有一种方法是利用锌与硫酸反应产生氢气,根据仪器和药品的质量的减少量就是生成氢气的质量,进而算出锌的质量,再利用锌的质量除以合金的总质量乘以百分之百.
点评:本题主要是利用锌与硫酸反应,铜与硫酸不反应,可以根据反应前后仪器和药品的质量的减少量就是氢气的质量,去算锌的质量,也可以利用氢气排水的方法算出氢气的体积,再换算成质量进行计算.

练习册系列答案
 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
根据下列所给出的药品、实验装置和实验中可测得的数据,设计实验来粗略测定由铜和锌两种金属组成的合金a g中锌的质量分数(合金已加工成粉末).
药品:足量的浓硫酸、足量的稀硫酸、足量的稀硝酸和氧化铜.
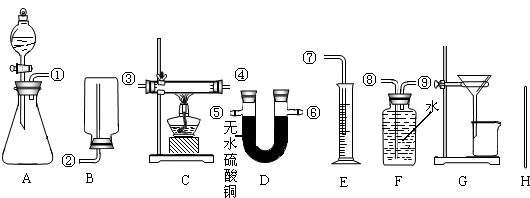
在实验中可测得的数据:
充分反应后,生成氢气的体积为bL(在此条件下,2.0gH2的体积是22.4L),反应前仪器和药品的质量为c g,充分反应后剩余固体的质量为d g,充分反应后仪器和药品的质量为e g.请你设计三个方案填入下表中:
药品:足量的浓硫酸、足量的稀硫酸、足量的稀硝酸和氧化铜.

在实验中可测得的数据:
充分反应后,生成氢气的体积为bL(在此条件下,2.0gH2的体积是22.4L),反应前仪器和药品的质量为c g,充分反应后剩余固体的质量为d g,充分反应后仪器和药品的质量为e g.请你设计三个方案填入下表中:
| 选用药品的名称(1) | 选用的实验装置及组装时接口的连接顺序(2) | 需测得的实验数据(从上述可测得的数据中选取)(3) | 合金中锌的质量分数的计算式(4) | ||
| 选用的实验装置序号 | 组装时接口编号的连接顺序(如不需要组装,则不填) | ||||
| 方案一 | |||||
| 方案二 | |||||
| 方案三 | |||||
化学实验室的开放日,老师安排化学兴趣小组的同学开展了有关NaCl和Na2CO3这两种常见的盐的实验,实验任务如下:
第一小组的同学:将失去标签的两瓶无色溶液(分别为NaCl和Na2CO3)区别开来
第二小组的同学:除去NaCl固体中的少量Na2CO3
第三小组的同学:测定Na2CO3和少量NaCl的固体混合物中Na2CO3质量分数
(1)第一小组的同学为了区别两瓶无色溶液,甲、乙、丙、丁四位同学分别选择下列物质进行实验.其中合理的是________(填写序号).
甲:稀盐酸 乙:AgNO3溶液 丙:澄清石灰水 丁:蓝色的石蕊试纸
(2)第二小组为了除去NaCl溶液中的少量Na2CO3,设计了如下的实验:
请回答下列问题:
①写出沉淀A的化学式________;②甲同学认为:加入CaCl2溶液后,分离除去沉淀A的实验操作方法是________;③乙同学发现此方案很容易引入新的杂质,他们提出新的方案:将混合物溶解,若滴加盐酸至不再产生气体为止,则既能除去Na2CO3杂质,又能有效地防止新杂质的引入.写出有关反应的方程式________.
(3)第三小组的同学根据下列所给出的药品、实验装置和实验中可测得的数据,设计实验来粗略测定Na2CO3和NaCl的固体混合物ag中Na2CO3的质量分数.
药品:足量的稀H2SO4、CaCl2溶液、碱石灰(烧碱和氧化钙的混合物)、浓硫酸
实验装置如图2:
在实验中可测得的数据:①充分反应后,生成沉淀的质量为bg; ②反应前装置和药品的质量为c g;③充分反应后装置和药品的质量为d g.
请设计二个实验方案填入下表中(碱石灰和浓硫酸已被选用,下表中不再填写):
| 方案 | 选用的药品 | 选用的实验装置及组装时接口连接顺序 | 需测得的实验数据(从上述可测得的数据中选取) | 混合物中Na2CO3的质量分数计算式 | |
| 选用的实验装置序号 | 组装时接口编号顺序 | ||||
| 一 | ________ | A、B、D、F | (毋须填写) | ________ | ________ |
| 二 | ________ | ________ | ________ | ag、cg、dg | ________ |
根据下列所给出的药品、实验装置和实验中可测得的数据,设计实验来粗略测定由铜和锌两种金属组成的合金a g中锌的质量分数(合金已加工成粉末).
药品:足量的浓硫酸、足量的稀硫酸、足量的稀硝酸和氧化铜.
在实验中可测得的数据:
充分反应后,生成氢气的体积为bL(在此条件下,2.0gH2的体积是22.4L),反应前仪器和药品的质量为c g,充分反应后剩余固体的质量为d g,充分反应后仪器和药品的质量为e g.请你设计三个方案填入下表中:
药品:足量的浓硫酸、足量的稀硫酸、足量的稀硝酸和氧化铜.

在实验中可测得的数据:
充分反应后,生成氢气的体积为bL(在此条件下,2.0gH2的体积是22.4L),反应前仪器和药品的质量为c g,充分反应后剩余固体的质量为d g,充分反应后仪器和药品的质量为e g.请你设计三个方案填入下表中:
| 选用药品的名称(1) | 选用的实验装置及组装时接口的连接顺序(2) | 需测得的实验数据(从上述可测得的数据中选取)(3) | 合金中锌的质量分数的计算式(4) | ||
| 选用的实验装置序号 | 组装时接口编号的连接顺序(如不需要组装,则不填) | ||||
| 方案一 | |||||
| 方案二 | |||||
| 方案三 | |||||
