题目内容
【题目】化学为人类社会的可持续发展做出了巨大贡献目前人类使用的主要能源是化石燃料,会加剧温室效应。发展“低碳生活”是当今社会发展的趋势。
(1)化石燃料指的是_______、_______、_______。
(2)下列做法符合“低碳生活”的是_______。
①提倡使用一次性筷子 ②步行代替开私家车 ③日常生活耗用的能量尽量少
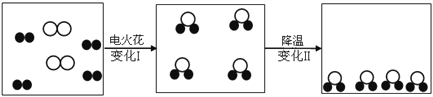
(3)舍勒是最早制得氧气的化学家之一,他获得氧气的方法主要有以下两种:
a.加热分解硝酸钾、氧化汞、硝酸银等
b.用二氧化锰与浓硫酸加热:![]()
①a中反应物均可制得氧气,因为他们组成的共同点是______
②b中物质X的化学式是______,H2SO4的一个分子中有______个原子。
(4)拉瓦锡通过定量分析实验,获得化学的重要定律——质量守恒定律。
①由质量守恒定律可知,化学反应前后一定不变的是______(填字母序号,下同),可能变化的是______。
A.原子种类 b.原子数目 c.分子种类 d.分子数目 e.元素种类 f.物质种类
②已知5gX恰好与10gY化合生成新物质Z。现有X、Y各15g,完全反应后生成Z的质量为______g。
【答案】 煤 石油 天然气 ②③ 都含氧元素 H2O 7 abe d 【答题空10】22.5
【解析】(1)化石燃料指的是煤、石油、天然气;
(2)①经常使用一次性筷子,要消耗大量的木材资源,不符合低碳生活理念,错误;②步行代替开私家车,节约能源,减少大气污染,符合低碳生活理念,正确;③日常生活耗用的能量尽量少,符合低碳生活理念,正确。故选②③;
(3)①加热分解硝酸钾、氧化汞、硝酸银等可制得氧气,因为它们组成中都含氧元素;
②利用质量守恒定律反应前后元素种类不变,反应前有2个Mn、8个O、4个H、2个S;反应后有2个Mn、6个O、2个S;故2x中含有4个H,2个O;故x的化学式为H2O;一个硫酸分子中含有2个氢原子、1个硫原子和4个氧原子,共7个原子;
(4)①质量守恒定律是参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。化学反应前后,原子种类、原子数目、原子的质量不变,所以元素种类和元素的质量也一定不变;根据质量守恒定律可知反应前后物质的总质量不变。分子种类、物质种类一定改变;分子数目、元素化合价可能改变,也可能不改变;
②根据质量守恒定律可知,因为在化学反应X+Y=Z,已知5gX恰好与10gY化合生成新物质Z,则X、Y反应时的质量比为:5g:10g=1:2;现有X、Y各15g,因为当Y为15g时,X为15g×1/2=7.5g,完全反应后生成Z的质量为:7.5g+15g=22.5g。

 全优点练单元计划系列答案
全优点练单元计划系列答案【题目】实验研究是化学学习的重要方法。请以碳及其化合物的知识进行以下实验研究。
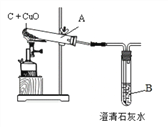
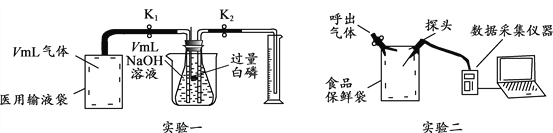
实验一:木炭还原氧化铜。
①观察到B中溶液变浑浊,试管A中的现象_______________,
A中反应的化学方程式为________,还原剂是__________。
②反应完全后,若先撤走酒精喷灯停止加热,可能导致的后果___________________________
实验二:为了探究某混合气体是由水蒸气、一氧化碳、二氧化碳3种气体组成, 设计了如下实验:
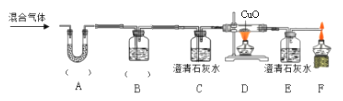
①欲探究混合气体中含有CO2和H2O蒸气,在图中的A、B装置内依次盛放的化学试剂为_______;检验出水蒸气的现象是_____________,反应的化学方程式为__________。
②装置E、F的作用分别是__________________ 、_____________________,E中反应的化学方程式为_____________。
③若没有装置E_______________(填“能”或“否”)证明混合气体中含有一氧化碳,请简述理由_____________________。
④实验结束后先熄灭装置D处的酒精灯,E中石灰水不会倒流的原因是____________。
⑤该实验中体现的一氧化碳的化学性质有__________________________。
实验三:有些化妆品中添加的高纯度碳酸钙可以用石灰石来制备,如下图。(假设石灰石中除碳酸钙外。所含杂质仅为SiO2,其不溶于水,高温不会分解,也不与盐酸反应)
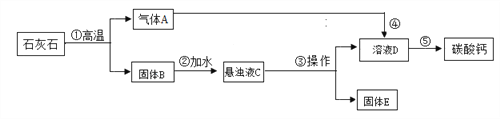
Ⅰ. 写出步骤①②中反应的化学方程式____________、____________。
Ⅱ. 气体A能使紫色石蕊试液变红色,反应的化学方程式为____________ 。
Ⅲ. 操作⑤的目的是________,用到的仪器主要有玻璃棒、酒精灯、铁架台(带铁圈)、__________。
Ⅳ. 为验证实验结束后得到的固体B中碳酸钙是否已经完全分解,请设计两种方案完成下表内容。
实验步骤 | 实验现象 | 结论 | |
方案一(66) | ________________ | ________________ | ________________ |
方案二(67) | ________________ | ________________ | ________________ |
【题目】下表是氯化钠和硝酸钾在不同温度下的溶解度。(假设硝酸钾与氯化钠同时溶解在水中各自的溶解度不变,实验过程中水分损失忽略不计)。
温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度(g/100g水) | KNO3 | 13.3 | 31.6 | 64.0 | 110.0 | 169.0 | 246.0 |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 | |
①由表可知,20℃时,氯化钠的溶解度是________。影响硝酸钾溶解度的因素是_________。
②在80℃的100g水中溶解NaCl和KNO3,进行以下实验:
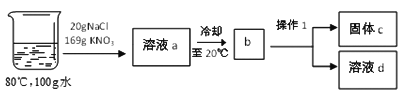
Ⅰ.操作1的名称是_________。
Ⅱ.溶液a冷却至b的过程中出现的现象是__________。溶液d中所含的溶质是_________。
Ⅲ.对整个实验过程分析正确的是_________。
A.无法判断a、d溶液中氯化钠溶液的状态 B.固体c是纯净物
C.溶液a中硝酸钾的质量分数为![]() D.硝酸钾溶液始终处于饱和状态
D.硝酸钾溶液始终处于饱和状态
【题目】石灰石进行煅烧实验,过程如下(假设杂质不发生变化)。
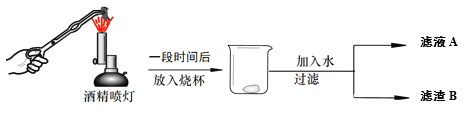
① 煅烧石灰石的化学方程式为____________________;
② 利用滤液A或滤渣B设计方案证明石灰石分解情况。
实验操作 | 判断依据 | 结论 |
_________ | __________ | 石灰石已分解 |
________ | ___________ | 石灰石完全分解 |
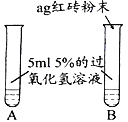
【题目】某中学化学课外兴趣小组的同学为了寻找新的催化剂,设计了如下探究方案。
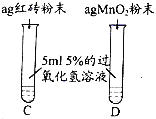
【提出问题】红砖粉末能否作为过氧化氢溶液分解的催化剂?如果能,效果如何?
【实验探究】
实验步骤 | 实验现象 | 实验结论及解释 |
Ⅰ. | A中无明显现象, B中产生大量能使带火星木条复燃的气体 | ① 产生的气体是___ ② 红砖粉末能改变过氧化氢分解速率 |
Ⅱ. 向B试管中重新加入5%的过氧化氢溶液,反应停止后过滤、洗涤、干燥、称量滤渣 | ① 又产生大量能使带火星木条复燃的气体 ② 滤渣质量等于ag | 红砖粉末的________和____________在反应前后均没有发生变化,能作过氧化氢分解的催化剂 |
Ⅲ. | 两试管中均产生气泡,但____(填“C”或“D”)试管中产生的气泡快。 | 红砖粉末的催化效果没有二氧化锰粉末好 |