题目内容
【题目】金属材料是日常生活中应用广泛的材料,请回答下列与金属有关的问题.
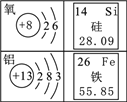
(1)汽车的外部材料如下图所示,含有的金属元素是____________(填元素符号)。
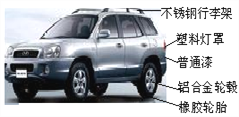
(2)汽车轮毂一般用铝合金材料而不用普通钢材的原因是___________,钢铁车身喷漆处理既美观又防锈,喷漆防锈的原理是_________。
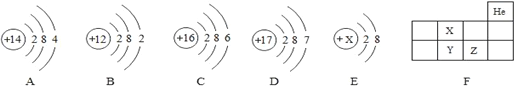
(3)对Ag、Fe、Cu三种金属活动性顺序的探究,下列所选试剂你认为不可行的是(__________)
A.Fe、Ag、CuSO4溶液 B.Cu、Ag、FeSO4溶液
C.Fe、Cu、稀盐酸、AgNO3溶液 D.Cu、FeSO4溶液、AgNO3溶液
(4)在AgNO3、Zn(NO3)2和Cu(NO3)2的混合溶液中加人一定量的铁粉,充分反应后过滤.向滤渣中加入稀盐酸,有气泡产生.根据上述现象,下列说法正确的有______
A.滤渣中一定有Zn B.滤渣中可能有Ag、Cu
C.滤液中﹣定有Fe(NO3)2、Zn(NO3)2 D.滤液中可能有AgNO3、Cu(NO3)2
(5)等质量的甲、乙、丙三种金属的粉末,与足量的稀硫酸反应(反应后甲、乙、丙三种金属均显+2价),生成H2的质量与反应时间的关系如下图所示,下列说法不正确的是(________)
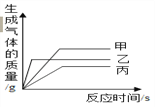
A、三种金属的活泼性:乙>甲>丙 B、生成氢气的质量:甲>乙>丙
C、相对原子质量:甲>乙>丙 D、消耗硫酸的质量:甲>乙>丙
【答案】 Fe Al 密度小 隔绝氧气和水 B C C
【解析】本题考查了金属的性质,金属的活动性的探究,综合性较强,难度不大,根据已有知识进行分析。
(1)汽车的外部材料如下图所示,含有的金属元素是Fe Al;
(2)汽车轮毂一般用铝合金材料而不用普通钢材的原因是密度小,钢铁车身喷漆处理既美观又防锈,喷漆防锈的原理是隔绝氧气和水;
(3)A、Fe、Ag、CuSO4溶液这三种物质中,Fe与CuSO4溶液反应,证明铁的活动性比铜强,Ag与CuSO4溶液不能反应,证明铜比银的活动性强,此方案可行;B、因为铁的活动性在三种金属中最强,所以Cu,Ag都不能和FeSO4溶液反应,得不出Cu,Ag的活动性强弱,此方案不可行;C、Fe,Cu,稀盐酸,AgNO3溶液四种物质中,铁能与稀盐酸反应,也能与AgNO3溶液反应,证明铁比氢和银的活动性强,铜和稀盐酸不反应,但能与AgNO3溶液反应,证明铜的活动性比氢弱,比银强,也能得出三种金属的活动性强弱,此方案可行;D、Cu、FeSO4溶液、AgNO3溶液这三种物质中,Cu与FeSO4溶液不反应,证明铁的活动性比铜强,Cu与AgNO3溶液能反应,证明铜比银的活动性强,可以证明三种金属的活动性强弱,此方案可行。故选B;
(4)充分反应后过滤,向滤出的固体中滴加稀盐酸,有气泡产生,此现象说明Fe过量,所以原混合溶液中的Cu(NO3)2、AgNO3全部被置换,生成Cu、Ag和Fe(NO3)2溶液。A、铁的活动性比锌弱,不会置换出硝酸锌中的锌,错误;B、向滤渣中加入稀盐酸,有气泡产生,说明铁过量,所以滤渣中一定有Ag、Cu,错误;C、铁会与原混合溶液中的Cu(NO3)2、AgNO3全部被置换生成Cu、Ag和Fe(NO3)2溶液,所以滤液中一定有Fe(NO3)2、Zn(NO3)2,正确;D、向滤渣中加入稀盐酸,有气泡产生,说明铁过量,滤液中一定没有硝酸铜和硝酸银,错误。故选C。
(5)A、根据反应生成H2的质量与反应时间的关系图所示,当三种金属都在发生反应时,相同时间内乙放出氢气的质量大于甲、大于丙,可判断三种金属活动性顺序是乙>甲>丙,正确;B、根据反应生成H2的质量与反应时间的关系图所示,在三种金属完全反应后,放出H2的质量是:甲>乙>丙,正确;C、三种金属的化合价、金属的质量都相等,完全反应放出氢气的质量与金属的相对原子质量成反比,即产生氢气多的相对原子质量小;根据反应生成H2的质量与反应时间的关系图所示,在三种金属完全反应后,放出H2的质量是甲>乙>丙,因此可判断相对原子质量是:丙>乙>甲,错误;D、金属与酸的反应生成氢气时,氢气来源于酸中的氢元素,所以生成的氢气与消耗的酸的多少顺序一致,消耗硫酸的质量:甲>乙>丙,正确。故选C。