题目内容
碳酸钠和氯化钠的固体混合物13.6g,与一定质量的稀盐酸恰好完全反应,得到10%的氯化钠溶液147g.计算:
(1)固体混合物中碳酸钠的质量分数;
(2)生成二氧化碳的质量;
(3)该盐酸中溶质的质量分数.
【答案】分析:(1)向碳酸钠和氯化钠的固体混合物中加入稀盐酸,只是碳酸钠与盐酸反应,反应后生成了氯化钠,该反应中要注意的是,最终得到的溶液中氯化钠,一部分是混合物种本身含有的,一部分是反应后生成的.可根据差量法求解.
(2)根据碳酸钠的质量,再根据反应的化学方程式可以求得二氧化碳的质量;
(3)根据碳酸钠的质量,根据反应的化学方程式可以求出盐酸溶质的质量,再依据溶质质量分数的计算式解答.
解答:解:本题第一问可用两种解法.
I、(1)147g氯化钠溶液中氯化钠的质量为;147g×10%=14.7g.
设原固体混合物中氯化钠的质量为x,则碳酸钠的质量为13.6g-x,生成氯化钠的质量为14.7g-x
Na2CO3 +2HCl=2NaCl+H2O+CO2↑
106 117
13.6g-x 14.7g-x

x=3g
所以混合物中碳酸钠的质量为13.6g-x=10.6g
混合物中碳酸钠的质量分数为: %=77.9%
%=77.9%
Ⅱ、差量法
(1)设 Na2CO3 的质量为X,运用差量法求解,△m为固体质量差
Na2CO3 +2HCl=2NaCl+H2O+CO2↑△m
106 117 117-106=11
X 147g×10%-13.6g=1.1g

X=10.6g
所以固体混合物中碳酸钠的质量分数为: %=77.9%
%=77.9%
(2)和(3)设生成二氧化碳的质量为y,参加反应的盐酸中溶质的质量为z.
Na2CO3 +2HCl=2NaCl+H2O+CO2↑
106 73 44
10.6g z y

z=7.3g

y=4.4g
由质量守恒定律可得反应前质量与反应后质量相等,生成物的总质量为溶液质量+气体质量=147g+4.4g=151.4g
则反应前稀盐酸的质量=总质量-混合物质量=151.4g-13.6g=137.8g
所以盐酸中溶质的质量分数 100%=5.3%?
100%=5.3%?
答:固体混合物中碳酸钠的质量分数为77.9%,产生二氧化碳为4.4g,该盐酸中溶质的质量分数5.3%.
点评:本题主要考查了根据化学方程式的计算,了解所得溶液中溶质包括固体中原有的氯化钠和生成的氯化钠是解题的关键,也可利用差量法来解答.
(2)根据碳酸钠的质量,再根据反应的化学方程式可以求得二氧化碳的质量;
(3)根据碳酸钠的质量,根据反应的化学方程式可以求出盐酸溶质的质量,再依据溶质质量分数的计算式解答.
解答:解:本题第一问可用两种解法.
I、(1)147g氯化钠溶液中氯化钠的质量为;147g×10%=14.7g.
设原固体混合物中氯化钠的质量为x,则碳酸钠的质量为13.6g-x,生成氯化钠的质量为14.7g-x
Na2CO3 +2HCl=2NaCl+H2O+CO2↑
106 117
13.6g-x 14.7g-x

x=3g
所以混合物中碳酸钠的质量为13.6g-x=10.6g
混合物中碳酸钠的质量分数为:
 %=77.9%
%=77.9%Ⅱ、差量法
(1)设 Na2CO3 的质量为X,运用差量法求解,△m为固体质量差
Na2CO3 +2HCl=2NaCl+H2O+CO2↑△m
106 117 117-106=11
X 147g×10%-13.6g=1.1g

X=10.6g
所以固体混合物中碳酸钠的质量分数为:
 %=77.9%
%=77.9%(2)和(3)设生成二氧化碳的质量为y,参加反应的盐酸中溶质的质量为z.
Na2CO3 +2HCl=2NaCl+H2O+CO2↑
106 73 44
10.6g z y

z=7.3g

y=4.4g
由质量守恒定律可得反应前质量与反应后质量相等,生成物的总质量为溶液质量+气体质量=147g+4.4g=151.4g
则反应前稀盐酸的质量=总质量-混合物质量=151.4g-13.6g=137.8g
所以盐酸中溶质的质量分数
 100%=5.3%?
100%=5.3%?答:固体混合物中碳酸钠的质量分数为77.9%,产生二氧化碳为4.4g,该盐酸中溶质的质量分数5.3%.
点评:本题主要考查了根据化学方程式的计算,了解所得溶液中溶质包括固体中原有的氯化钠和生成的氯化钠是解题的关键,也可利用差量法来解答.

练习册系列答案
相关题目
同学们在学习了盐的化学性质以后,开展了测定碳酸钠和氯化钠的固体混合物中碳酸钠的质量分数的探究实验,他们设计了以下实验方案
【方案一】气体转化法
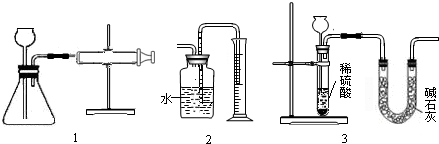
(1)如图1所示,把wg的混合物与足量稀硫酸反应后,测定产生的CO2的体积,检查该装置气密性的方法是 ;
(2)有同学提出用图2代替图1中的收集装置,则所测得CO2气体的体积 ;
(填偏大、偏小或不变)理由是 ,你的改进方案是 ;广口瓶内原有的空气对实验结果 (填“有”或“没有”)影响,如果利用改进后的装置测得CO2气体的体积为VmL (此时CO2的密度为Pg/mL)则原混合物中Na2CO3的质量分数的计算式为 ;
(3)也有人用图3装置测定CO2的质量(碱石灰的成分是CaO和NaOH的混合物)则图3实验装置中主要存在哪些缺陷?这些缺陷对实验结果有何影响?
【方案二】沉淀法(如图所示)
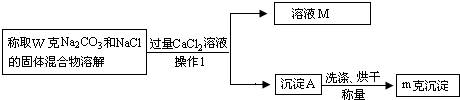
(1)沉淀A的化学式是 ,溶液M中溶质的化学式是 ;
(2)确定CaCl2溶液是否过量的方法是 ;
(3)该固体混合物中Na2CO3的质量分数的计算式为 ;
(4)导致测定结果偏大的原因可能是 ;
【方案三】盐酸滴定法

(1)“操作2”的名称是 ;
(2)根据实验数据计算该固体混合物中Na2CO3的质量分数为 (保留一位小数).
【方案一】气体转化法

(1)如图1所示,把wg的混合物与足量稀硫酸反应后,测定产生的CO2的体积,检查该装置气密性的方法是
(2)有同学提出用图2代替图1中的收集装置,则所测得CO2气体的体积
(填偏大、偏小或不变)理由是
(3)也有人用图3装置测定CO2的质量(碱石灰的成分是CaO和NaOH的混合物)则图3实验装置中主要存在哪些缺陷?这些缺陷对实验结果有何影响?
| 主 要 缺 陷 | 对实验结果的影响 |

(1)沉淀A的化学式是
(2)确定CaCl2溶液是否过量的方法是
(3)该固体混合物中Na2CO3的质量分数的计算式为
(4)导致测定结果偏大的原因可能是
【方案三】盐酸滴定法

(1)“操作2”的名称是
(2)根据实验数据计算该固体混合物中Na2CO3的质量分数为