题目内容
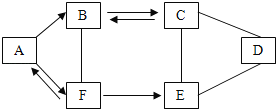
【题目】用“〇”和“●”分别表示氢原子和氧原子,如图是氢气与氧气在点燃条件下发生反应的微观模拟图。请回答下列问题:
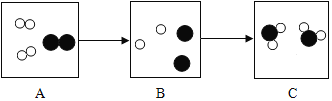
(1)在B图中将相关粒子图形补充完整_______;
(2)C中物质属于氧化物,从微观角度的解释是_____;
(3)结合该图示从微观角度解释由B到C变化的实质是_____。
【答案】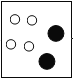 物质由同种的分子构成,分子是由两种原子构成,一种是氧原子 每两个氢原子和一个氧原子构成一个水分子
物质由同种的分子构成,分子是由两种原子构成,一种是氧原子 每两个氢原子和一个氧原子构成一个水分子
【解析】
(1)由质量守恒定律在反应前后原子的种类及数目不变可知,在B图中应补充两个氢原子,如下图: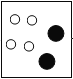
(2)C中物质属于氧化物,由微粒的构成可知,物质由同种的分子构成,分子是由两种原子构成,一种是氧原子;
(3)由微粒的变化可知,释由B到C变化的实质是:每两个氢原子和一个氧原子构成一个水分子。

 学习实践园地系列答案
学习实践园地系列答案【题目】小亮在做“盐酸中和氢氧化钠溶液”的实验时,滴加盐酸前忘了加入指示剂,导致无法判断该中和反应进行的程度。于是他对所得溶液的酸碱性进行探究。
(实验探究)稀盐酸与氢氧化钠反应的化学方程式为_____。
(提出猜想)所得溶液可能呈碱性,也可能呈_____性,还可能呈_____性。
(实验验证)
实验操作 | 实验现象 | 结论 |
用试管取该溶液1﹣2mL,滴入 1﹣2滴无色酚酞试液,振荡 | 无色酚酞试液变_____ | 溶液呈碱性 |
无色酚酞试液不变色 | 溶液呈_____ |
若无色酚酞试液不变色,为了进一步确定溶液的酸碱性,小亮提出了以下方案:
取样,加入金属锌,若有所泡产生,则所取溶液呈酸性,该反应的化学方程式为_____;若无明显现象,则溶液呈_____性。
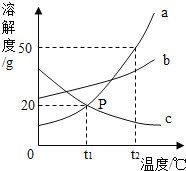
(分析论证)如图是小亮同学根据实验绘制的溶液的pH随加入溶液的质量变化的曲线。
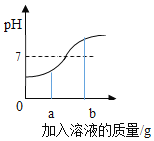
①氢氧化钠与盐酸恰好完完全反应时,溶液的pH_____7(填“>“<”或“=”)
②根据曲线判断,小亮是将_____(填“氢氧化钠溶液”或“盐酸”,下同)滴入_____中。
③当滴入溶液的质量为bg时,向所得溶液中滴加酚酞溶液,溶液颜色为_____色,此时溶液中的溶质是_____、_____。
【题目】在一支试管中放入一小段镁条(已擦去氧化膜),再向试管中加入一定量的盐酸,镁条表面有________产生,反应的化学方程式是________________________________________________________。
[发现问题]为了再次观察上述反应现象,小林同学用较长的镁条重做上述实验,但发现了异常现象,试管中出现了白色沉淀。
[实验验证1]小林同学针对两次实验的不同,设计对比实验方案,探究出现异常现象的原因。
试管(盛有同体积同浓度的盐酸) | ① | ② | ③ | ④ |
镁条长度 | 1cm | 2cm | 3cm | 4cm |
相同的实验现象(省略题干现象) | 快速反应,试管发热,镁条全部消失 | |||
沉淀量差异(恢复至20℃) | 无 | 少量 | 较多 | 很多 |
[得出结论]镁条与盐酸反应产生白色沉淀与________有关。
[追问]白色沉淀是什么物质?
[查阅资料]①20 ℃时,100 g水中最多能溶解氯化镁54.8 g;
②镁能与热水反应产生一种碱和氢气;
③氯化银既不溶于水也不溶于稀硝酸。
[做出猜想]猜想一:镁;猜想二:氯化镁;猜想三:氢氧化镁,猜想的依据是____________________(用化学方程式表示)。
[实验验证2]将白色沉淀洗涤干净,分别取少量沉淀于A、B、C试管中,进行如表实验:
试管 | 操作 | 现象 | 结论 |
A | 加入足量盐酸 | ________,白色沉淀________ | 猜想一不正确,但这种白色沉淀能溶于盐酸 |
B | 加入足量水 | 白色沉淀________ | 猜想二不正确 |
C | 加入适量稀硝酸 | 白色沉淀消失 | 原白色沉淀中含有的离子是: |
继续滴加几滴硝酸银溶液 | 出现大量白色沉淀 |