题目内容
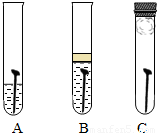 防止金属腐蚀,特别是钢铁的锈蚀是世界科学研究和技术领域中的重大问题.某同学为了探究铁生锈与哪些因素有关,设计了一个实验(如图所示):该同学找到三个铁钉,经过酸洗除锈、干燥后,分别放入A、B、C三支试管中;再向A、B试管中各注入煮沸后迅速冷却的蒸馏水,A中的铁钉部分浸入水中,B中的铁钉浸没水中,并在水面上注入一层植物油;C中放入一团裹有干燥剂
防止金属腐蚀,特别是钢铁的锈蚀是世界科学研究和技术领域中的重大问题.某同学为了探究铁生锈与哪些因素有关,设计了一个实验(如图所示):该同学找到三个铁钉,经过酸洗除锈、干燥后,分别放入A、B、C三支试管中;再向A、B试管中各注入煮沸后迅速冷却的蒸馏水,A中的铁钉部分浸入水中,B中的铁钉浸没水中,并在水面上注入一层植物油;C中放入一团裹有干燥剂CaCl2的棉花并塞上橡皮塞.请你和该同学一起回答下列问题:
(1)写出一个酸洗除锈(铁锈的主要成分是Fe2O3)反应的化学方程式:______.
(2)在三支试管中,容易生锈的是______中的铁钉.因此铁生锈的条件是______.
(3)为了防止铁制品生锈,应采取的措施是:______(写出一种).
【答案】分析:(1)氧化铁属于金属氧化物,能与酸反应生成盐和水,故可用酸除去铁锈,据此写出反应的化学方程式即可.
(2)铁制品锈蚀的过程,实际上是铁与空气中的氧气、水蒸气等发生化学反应的过程,据此进行分析解答.
(3)根据铁制品生锈的条件,铁制品与氧气和水隔绝就可以防止钢铁生锈,据此进行分析解答.
解答:解:(1)氧化铁属于金属氧化物,能与酸反应生成盐和水,故可用稀盐酸或稀硫酸等除去铁锈,反应的化学方程式为:Fe2O3+6HCl═2FeCl3+3H2O(或Fe2O3+3H2SO4═Fe2(SO4)3+3H2O).
(2)铁制品锈蚀的过程,实际上是铁与空气中的氧气、水蒸气等发生化学反应的过程,A中的铁钉最易与氧气、水分接触,最容易生锈.
(3)防止铁制品生锈,除了保持铁制品干燥外,还有很多其它方法,如隔绝氧气可以防止铁生锈,在铁制品表面涂油漆、镀一层金属等方法可以使铁制品与氧气隔绝.
故答案为:(1)Fe2O3+6HCl═2FeCl3+3H2O(或Fe2O3+3H2SO4═Fe2(SO4)3+3H2O);
(2)A;铁与水、空气(或氧气)接触;
(3)保持铁制品干燥(或涂油、刷油漆、镀其它金属等).
点评:本题难度不大,掌握铁生锈的条件、防锈的措施、酸的化学性质、化学方程式的书写等即可正确解答本题.
(2)铁制品锈蚀的过程,实际上是铁与空气中的氧气、水蒸气等发生化学反应的过程,据此进行分析解答.
(3)根据铁制品生锈的条件,铁制品与氧气和水隔绝就可以防止钢铁生锈,据此进行分析解答.
解答:解:(1)氧化铁属于金属氧化物,能与酸反应生成盐和水,故可用稀盐酸或稀硫酸等除去铁锈,反应的化学方程式为:Fe2O3+6HCl═2FeCl3+3H2O(或Fe2O3+3H2SO4═Fe2(SO4)3+3H2O).
(2)铁制品锈蚀的过程,实际上是铁与空气中的氧气、水蒸气等发生化学反应的过程,A中的铁钉最易与氧气、水分接触,最容易生锈.
(3)防止铁制品生锈,除了保持铁制品干燥外,还有很多其它方法,如隔绝氧气可以防止铁生锈,在铁制品表面涂油漆、镀一层金属等方法可以使铁制品与氧气隔绝.
故答案为:(1)Fe2O3+6HCl═2FeCl3+3H2O(或Fe2O3+3H2SO4═Fe2(SO4)3+3H2O);
(2)A;铁与水、空气(或氧气)接触;
(3)保持铁制品干燥(或涂油、刷油漆、镀其它金属等).
点评:本题难度不大,掌握铁生锈的条件、防锈的措施、酸的化学性质、化学方程式的书写等即可正确解答本题.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
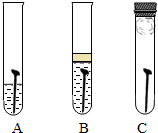 (2005?宁夏)防止金属腐蚀,特别是钢铁的锈蚀是世界科学研究和技术领域中的重大问题.某同学为了探究铁生锈与哪些因素有关,设计了一个实验(如图所示):该同学找到三个铁钉,经过酸洗除锈、干燥后,分别放入A、B、C三支试管中;再向A、B试管中各注入煮沸后迅速冷却的蒸馏水,A中的铁钉部分浸入水中,B中的铁钉浸没水中,并在水面上注入一层植物油;C中放入一团裹有干燥剂
(2005?宁夏)防止金属腐蚀,特别是钢铁的锈蚀是世界科学研究和技术领域中的重大问题.某同学为了探究铁生锈与哪些因素有关,设计了一个实验(如图所示):该同学找到三个铁钉,经过酸洗除锈、干燥后,分别放入A、B、C三支试管中;再向A、B试管中各注入煮沸后迅速冷却的蒸馏水,A中的铁钉部分浸入水中,B中的铁钉浸没水中,并在水面上注入一层植物油;C中放入一团裹有干燥剂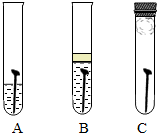 防止金属腐蚀,特别是钢铁的锈蚀是世界科学研究和技术领域中的重大问题.某同学为了探究铁生锈与哪些因素有关,设计了一个实验(如图所示):该同学找到三个铁钉,经过酸洗除锈、干燥后,分别放入A、B、C三支试管中;再向A、B试管中各注入煮沸后迅速冷却的蒸馏水,A中的铁钉部分浸入水中,B中的铁钉浸没水中,并在水面上注入一层植物油;C中放入一团裹有干燥剂
防止金属腐蚀,特别是钢铁的锈蚀是世界科学研究和技术领域中的重大问题.某同学为了探究铁生锈与哪些因素有关,设计了一个实验(如图所示):该同学找到三个铁钉,经过酸洗除锈、干燥后,分别放入A、B、C三支试管中;再向A、B试管中各注入煮沸后迅速冷却的蒸馏水,A中的铁钉部分浸入水中,B中的铁钉浸没水中,并在水面上注入一层植物油;C中放入一团裹有干燥剂
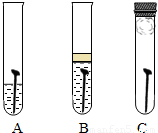 防止金属腐蚀,特别是钢铁的锈蚀是世界科学研究和技术领域中的重大问题.某同学为了探究铁生锈与哪些因素有关,设计了一个实验(如图所示):该同学找到三个铁钉,经过酸洗除锈、干燥后,分别放入A、B、C三支试管中;再向A、B试管中各注入煮沸后迅速冷却的蒸馏水,A中的铁钉部分浸入水中,B中的铁钉浸没水中,并在水面上注入一层植物油;C中放入一团裹有干燥剂
防止金属腐蚀,特别是钢铁的锈蚀是世界科学研究和技术领域中的重大问题.某同学为了探究铁生锈与哪些因素有关,设计了一个实验(如图所示):该同学找到三个铁钉,经过酸洗除锈、干燥后,分别放入A、B、C三支试管中;再向A、B试管中各注入煮沸后迅速冷却的蒸馏水,A中的铁钉部分浸入水中,B中的铁钉浸没水中,并在水面上注入一层植物油;C中放入一团裹有干燥剂