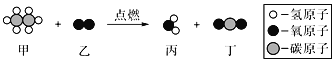
题目内容
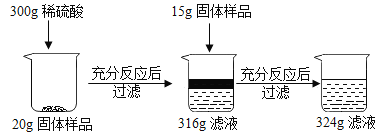
【题目】现有铜和氧化铜的固体混合物粉末,为研究其组成情况,进行如下实验,请回答下列问题:
(1)上述实验过程中发生反应的化学方程式为______。
(2)样品中单质Cu的质量分数是______;
(3)第一次反应后所得316g滤液中的溶质是______
(4)根据已知条件列出求解300g稀硫酸中溶质质量(X)的比例式______。
(5)若向最终滤液中加入76g水,所得不饱和溶液中溶质的质量分数为_____
(6)配制上述所需的稀硫酸,需要质量分数为98%的浓硫酸和水的质量比是______。
【答案】CuO+H2SO4=CuSO4+H2O 20% CuSO4、H2SO4 80/98=24g/X 12% 1:9
【解析】
根据300g稀硫酸加入20g固体导致溶液质量增加了16g,说明此时反应的氧化铜的质量为16g。而继续加入15g固体样品,导致溶液质量增加了8g,说明此时稀硫酸完全反应,氧化铜过量。据此结合氧化铜的质量和对应的化学方程式求算稀硫酸中溶质的只以及生成的硫酸铜的质量,进而求算对应的质量分数。
(1)由题意可知,氧化铜能与稀硫酸反应生成了硫酸铜和水,反应的化学方程式是:CuO+H2SO4=CuSO4+H2O;
(2)根据300g稀硫酸加入20g固体导致溶液质量增加了16g,说明此时反应的氧化铜的质量为16g;而继续加入15g固体样品,导致溶液质量增加了8g,反应的氧化铜的总质量为16g+8g=24g,说明此时稀硫酸完全反应,氧化铜过量;样品中铜的质量分数是![]()
![]() 100%=20%;
100%=20%;
(3)根据上面的分析可知,第一次反应后所得316g滤液中的溶质是:剩余的H2SO4和生成的CuSO4;
(4)设稀硫酸中溶质质量为x,生成硫酸铜的质量为y,
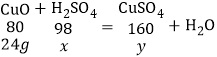
![]() x=29.4g,
x=29.4g,
![]() y=48g,
y=48g,
(5)向最终滤液中加入76g水,所得不饱和溶液中溶质的质量分数为:![]() ×100%=12%;
×100%=12%;
(6)稀硫酸的溶质质量分数是:![]() ×100%=9.8%;设配制上述所需的稀硫酸需要质量分数为98%的浓硫酸和水的质量分别为m、n,则:
×100%=9.8%;设配制上述所需的稀硫酸需要质量分数为98%的浓硫酸和水的质量分别为m、n,则:![]() ×100%=9.8%,
×100%=9.8%,![]() =
=![]() 。
。

 名校课堂系列答案
名校课堂系列答案