题目内容
【题目】在点燃条件下,4.4gC3H8与12.8g氧气恰好完全反应,生成7.2g水、4.4g二氧化碳和agX。则:
(1)a=_____;
(2)X的化学式为________;
(3)该反应的化学方程式为________。
【答案】5.6 CO C3H8+4O2![]() 4H2O+CO2+2CO
4H2O+CO2+2CO
【解析】
(1)由质量守恒定律可知,反应物的总质量与生成物的总质量相等;故X=4.4g+12.8g-7.2g-4.4g=5.6g,故X的质量为5.6g;
(2)4.4gC3H8含有C元素的质量为4.4×![]() =3.6g,含有H元素的质量为4.4g-3.6g=0.8g;
=3.6g,含有H元素的质量为4.4g-3.6g=0.8g;
12.8g氧气中含有O的质量为12.8g;
7.2g水中含有H元素的质量为7.2g×![]() =0.8g,含有O元素的质量为7.2g-0.8g=6.4g;
=0.8g,含有O元素的质量为7.2g-0.8g=6.4g;
4.4g二氧化碳中含有O元素的质量为4.4g×![]() =3.2g,含有C元素的质量为1.2g。
=3.2g,含有C元素的质量为1.2g。
由质量守恒定律可知X中含有3.6g-1.2g=2.4gC元素和12.8g-6.4g-3.2g=3.2gO元素,二者的原子个数比为1:1,故X的化学式为CO;
(3)C3H8与氧气反应生成水、二氧化碳和一氧化碳,则反应的化学方程式为
C3H8+4O2![]() 4H2O+CO2+2CO。
4H2O+CO2+2CO。

练习册系列答案
相关题目
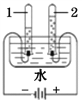
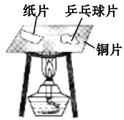
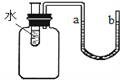
【题目】根据下图所示实验分析得出的结论中,不正确的是
| . |
A.二氧化碳与水反应生成碳酸 | B.正极相连的玻璃管中生成的是氧气 |
|
水中加入NaOH,看到U形管a侧液 面下降,b侧液面上升 |
C.说明不同物质着火点不同 | D. NaOH溶解在水中要放热 |
A. A B. B C. C D. D