题目内容
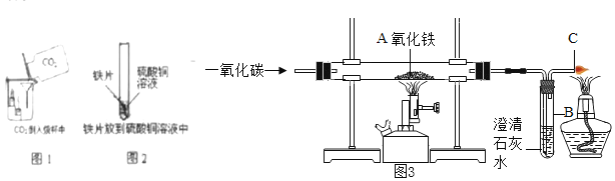
【题目】现欲探究一固体混合物A的成分,已知其中可能含有Ba(NO3)2、CuO、Na2CO3、NaCl四种物质中的两种或多种,按图所示进行实验,出现的现象如图中所述(设过程中所有可能发生的反应都恰好完全进行)。试根据实验过程和发生的现象做出判断,填写以下空白:
(1)常温下,气体B的水溶液显_____(填“酸性“”中性“”碱性”之一)。
(2)沉淀D的颜色为_____,其化学式为_____,蓝色沉淀F的化学式是_____。
(3)滤液E中一定大量存在的金属阳离子为(写离子符号)_____。
(4)混合物A中,肯定存在的物质是(写化学式)_____。
(5)写出实验过程中①中一定发生的一个化学反应方程式:_____。
【答案】酸性 白色; BaSO4; Cu(OH)2。 Ba2+ 和 Na+。 Ba(NO3)2、CuO、Na2CO3。 Ba(NO3)2+H2SO4=BaSO4↓+2HNO3;或者Cu+H2SO4=CuSO4+H2O;或者Na2CO3+H2SO4=Na2SO4+H2O+CO2↑。
【解析】
气体B能够使澄清石灰水变浑浊,说明B为二氧化碳,则元化合物一定含有碳酸钠。溶液C加入氢氧化钡后生成蓝色沉淀F,则蓝色沉淀F为氢氧化铜,溶液中含有氢氧化钡所带入的钡离子以及原混合物中的钠离子。由于D不能溶解于硝酸,所以该沉淀为硫酸钡,所以原物质含有硝酸钡和氧化铜以及碳酸钠。
(1)气体B为二氧化碳,所以常温下,气体B即二氧化碳的水溶液显酸性。
(2)沉淀D为硫酸钡,颜色为白色,其化学式为 BaSO4,蓝色沉淀F的化学式是 Cu(OH)2。
(3)滤液E含有原混合物中钠离子以及氢氧化钡中的钡离子,所以一定大量存在的金属阳离子为Ba2+和 Na+。
(4)混合物A中,肯定存在的物质是Ba(NO3)2、CuO、Na2CO3。
(5)写出实验过程中①中一定发生的一个化学反应方程式:Ba(NO3)2+H2SO4=BaSO4↓+2HNO3;或者Cu+H2SO4=CuSO4+H2O;或者Na2CO3+H2SO4=Na2SO4+H2O+CO2↑。

【题目】实验是科学探究的重要方法,让们一起再认识空气中氧气含量的测定拉瓦锡实验方案(如图1)利用汞的反应与图2相比,图2的优点_______(一条即可)
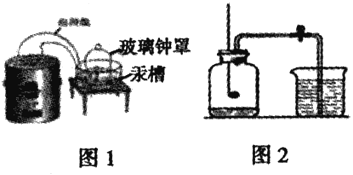
(实验回顾)兴趣小组的同学利用课本中的 实验方案(如图2)测定空气中氧气的含量,但测出的氧气的体积分数明显小于1/5。
请你参与探究:
(提出问题)造成误差的原因是什么?如何改进课本上的实验装置?
(查阅资料)红磷、白磷的一些性质如下表:
颜色、状态 | 熔点/℃ | 着火点/℃ | 密度/(g/cm3) | |
红磷 | 暗红色固体 | 590 | 240 | 2.34 |
白磷 | 白色或黄色固体 | 44.1 | 40 | 1.82 |
(猜想与假设)
甲同学;可能是导管内原含有空气,后来残留有吸入的水,影响实验的准确性。
乙同学:可能是瓶内残留气体中还有氧气。
你还能作出的猜想是____________。
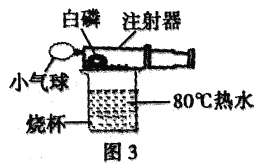
(实验与交流)在老师的指导下,小组同学对课本上的实验装置进行了图3所示的改进(其他仪器忽略)。
(1)甲同学提出应把红磷换为白磷,理由是________________________。
(2)写出白磷燃烧的化学方程式________________________。
(3)与课本上的实验装置相比较,该装置的一个优点是________________________。
(探究与反思)
(4)大家用改进的实验装置进行实验,待注射器冷却、管内白烟消失后,又意外发现注射器内壁附着黄色固体,该黄色固体的主要成分可能是______________________。
(5)为了验证乙同学的猜想,在老师的指导下,兴趣小组 的闻学又利用传感器改进实验装置(如图4),分别用过量的红磷和白磷进行对照实验,并用高能激光笔点燃磷。
①用测量氧气浓度的传感器测得反应后装置内氧气 浓度分别是:红磷为8.7%和白磷为1.0% ,从而证明乙同学的猜想___________(填“正确”或“错误”),但也有同学认为白磷也不能准确测定空气中氧气含量的原因是_________________________________。
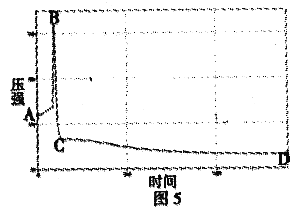
②如图5是白磷燃烧过程中的压强变化趋势,试分析回答:图中AB段变化的原因是______________________; BC段变化的原因是______________________。
【题目】学校化学兴趣小组的同学们为了测定石灰石样品中碳酸钙的质量分数,取用一定量石灰石样品研成粉末,称取l00g样品高温加热(样品中除碳酸钙外,其余成分受热的不发生反应),然后把剩余圄体放在干燥器中冷却后进行称量,重复四次操作,得实验数据如下表:
称 量 | 第一次 | 第二次 | 第三次 | 第四次 |
剩余固体的重量 | 67.2g | 65.6g | 64.8g | 64.8g |
计算:(1)生成的二氧化碳的质量是多少________g?
(2)该石灰石样品中碳酸钙的质量分数_______?