题目内容
(2012?泰宁县模拟)我国是世界钢铁产量最大的国家,炼铁的主要原料是铁矿石.用赤铁矿石(主要成分为Fe2O3)炼铁的反应原理为:Fe2O3+3CO
2Fe+3CO2
(1)根据化学式计算:Fe2O3中铁元素的质量分数;
(2)根据化学方程式计算:用含Fe2O360%的赤铁矿石800t,理论上可炼出铁多少吨?
| ||
(1)根据化学式计算:Fe2O3中铁元素的质量分数;
(2)根据化学方程式计算:用含Fe2O360%的赤铁矿石800t,理论上可炼出铁多少吨?
分析:(1)根据化合物中元素的质量分数=
×100%,进行分析解答.
(2)由赤铁矿石的质量、氧化铁的质量分数,根据赤铁矿炼铁的化学方程式可以列式计算出理论上可炼出铁的质量.
| 相对原子质量×原子个数 |
| 相对分子质量 |
(2)由赤铁矿石的质量、氧化铁的质量分数,根据赤铁矿炼铁的化学方程式可以列式计算出理论上可炼出铁的质量.
解答:解:(1)Fe2O3的相对分子质量为56×2+16×3=160,Fe2O3中铁元素的质量分数为
×100%=70%.
(2)设理论上可炼出铁的质量为x.
Fe2O3+3CO
2Fe+3CO2
160 112
800t×60% x
=
x=336t
答:(1)Fe2O3中铁元素的质量分数为70%;
(2)理论上可炼出铁的质量为336t.
| 56×2 |
| 160 |
(2)设理论上可炼出铁的质量为x.
Fe2O3+3CO
| ||
160 112
800t×60% x
| 160 |
| 112 |
| 800t×60% |
| x |
答:(1)Fe2O3中铁元素的质量分数为70%;
(2)理论上可炼出铁的质量为336t.
点评:本题难度不大,考查含杂质物质的化学方程式的计算,注意代入方程式计算的必须是纯物质的质量是正确解答此类题的关键.

练习册系列答案
相关题目
 (2012?泰宁县模拟)下表是硝酸钾在不同温度时的溶解度.
(2012?泰宁县模拟)下表是硝酸钾在不同温度时的溶解度.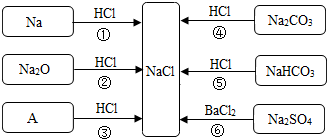 (2012?泰宁县模拟)图是对生成氯化钠反应关系的归纳与整理.请回答下列问题:
(2012?泰宁县模拟)图是对生成氯化钠反应关系的归纳与整理.请回答下列问题: