题目内容
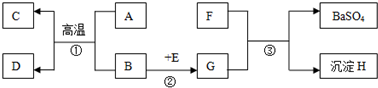
化工厂A、B、C、D四个车间排放的污水中,分别含有污染物CuCl2、HCl、Na2CO3、NaOH中的一种.现对污水的处理过程和产生的现象叙述如下:
(1)将A污水与B的蓝色污水通入第一反应池产生兰色沉淀;
(2)将C污水与D的酸性污水通入第二反应池产生大量气泡;
(3)将第一反应池上层的碱性污水与第二反应池流出的酸性污水通入第三反应池,最终污水显中性,再向外排放.
试推断A、B、C、D各是什么物质?最终向外排放的水中含有什么溶质?写出全部化学反应方程式.
(1)将A污水与B的蓝色污水通入第一反应池产生兰色沉淀;
(2)将C污水与D的酸性污水通入第二反应池产生大量气泡;
(3)将第一反应池上层的碱性污水与第二反应池流出的酸性污水通入第三反应池,最终污水显中性,再向外排放.
试推断A、B、C、D各是什么物质?最终向外排放的水中含有什么溶质?写出全部化学反应方程式.
(1)B中的污水是蓝色,可以知道B中含有氯化铜,A和氯化铜反应会生成沉淀,A是碳酸钠或氢氧化钠,D中的是酸性污水,所以D就是盐酸,C和盐酸反应会产生气泡,所以C中有碳酸钠,则A中就含有氢氧化钠,故答案为:A.NaOH B.CuCl2 C.Na2CO3 D.HCl;
(2)氯化铜和氢氧化钠反应生成氢氧化铜沉淀和氯化钠,又知道第一池是碱性污水,所以第一池中的溶质有氢氧化钠和氯化钠;碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,又知道第二池是酸性污水,所以第二池中的溶质有氯化氢和氯化钠,
最终流出的水呈中性,说明了盐酸和氢氧化钠发生了反应,生成了氯化钠和水,故答案为:NaCl
(3)第一反应池发生的反应是氯化铜和氢氧化钠反应产生氢氧化铜产生和氯化钠,反应的方程式为:CuCl2+2NaOH=Cu(OH)2↓+2NaCl;
第二反应池发生的反应是碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,反应的方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑;
第三反应池的反应是氢氧化钠和盐酸发生中和反应生成氯化钠和水,反应的方程式为:NaOH+HCl=NaCl+H2O;
故答案为:CuCl2+2NaOH=Cu(OH)2↓+2NaCl;Na2CO3+2HCl═2NaCl+H2O+CO2↑;NaOH+HCl=NaCl+H2O.
(2)氯化铜和氢氧化钠反应生成氢氧化铜沉淀和氯化钠,又知道第一池是碱性污水,所以第一池中的溶质有氢氧化钠和氯化钠;碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,又知道第二池是酸性污水,所以第二池中的溶质有氯化氢和氯化钠,
最终流出的水呈中性,说明了盐酸和氢氧化钠发生了反应,生成了氯化钠和水,故答案为:NaCl
(3)第一反应池发生的反应是氯化铜和氢氧化钠反应产生氢氧化铜产生和氯化钠,反应的方程式为:CuCl2+2NaOH=Cu(OH)2↓+2NaCl;
第二反应池发生的反应是碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,反应的方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑;
第三反应池的反应是氢氧化钠和盐酸发生中和反应生成氯化钠和水,反应的方程式为:NaOH+HCl=NaCl+H2O;
故答案为:CuCl2+2NaOH=Cu(OH)2↓+2NaCl;Na2CO3+2HCl═2NaCl+H2O+CO2↑;NaOH+HCl=NaCl+H2O.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案
相关题目