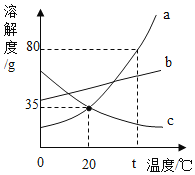
题目内容
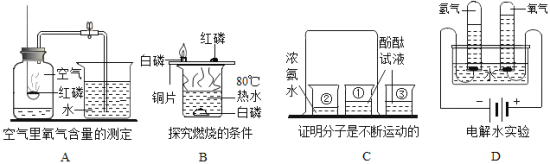
【题目】如图是某同学设计的某些实验装置,回答下列问题:
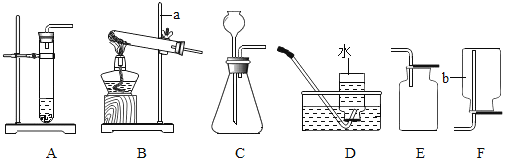
(1)写出图中仪器a和b的名称:a_____;b_____。
(2)用过氧化氢和二氧化锰制取氧气可选用的发生装置是_____,收集装置可选用_____。
(3)A装置检查气密性的方法是_____。
A 先把导管放入水中,后用手捂住试管,看导管口是否有气泡冒出
B 先用手捂住试管,后把导管放入水中,看导管口是否有气泡冒出
(4)①实验室用高锰酸钾制取并收集氧气可采用的装置组合是_____,反应的符号表达式为_____,属于什么基本反应类型_____。
②实验室用高锰酸钾制取并收集氧气的主要操作有:
①从水槽中撤出导管; ②收集气体; ③固定装置; ④检查装置的气密性; ⑤加热; ⑥撤酒精灯; ⑦装药品,正确的操作顺序是_____
A.④⑦③⑤②①⑥ B.⑦④③⑤②⑥① C.①②③④⑤⑥⑦ D.④⑦③⑤②⑥①
在完成“②收集气体”步骤时,应当_____时收集气体。
③实验室用高锰酸钾制取并收集氧气,需要在试管口塞一团疏松的棉花,其作用是_____。
(5)对比上述两种制取氧气的方法,从安全、节能、环保、简便等方面考虑,实验室制取氧气的反应物最好用_____(填“高锰酸钾”或“过氧化氢”)
【答案】铁架台 集气瓶 A或C D或E A BD或BE ![]() 分解反应 A 等到导管口的气泡连续均匀冒出 防止高锰酸钾颗粒进入导气管 过氧化氢
分解反应 A 等到导管口的气泡连续均匀冒出 防止高锰酸钾颗粒进入导气管 过氧化氢
【解析】
(1)仪器a是铁架台;b是集气瓶;故填:铁架台;集气瓶;
(2)用过氧化氢和二氧化锰制取氧气属于固液常温型,所以选择装置A或C来制取;氧气的密度比空气大,不易溶于水,所以可用向上排空气法或排水法来收集;故填:A或C;D或E;
(3)A装置检查气密性的方法是先把导管放入水中,后用手捂住试管,看导管口是否有气泡冒出;故填:A;
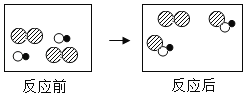
(4)①用加热高锰酸钾制取氧气,同时生成锰酸钾和二氧化锰,属于固体加热型,故选择装置B来制取;该反应符合“一变多”的特征,属于分解反应;氧气的密度比空气大,不易溶于水,所以可用向上排空气法或排水法来收集;故填:BD或BE;![]() ;分解反应;
;分解反应;
②实验室加热高锰酸钾制取氧气的操作步骤和注意点分别是:连(连接仪器、组装实验装置)→查(检查装置的气密性)→装(装入固体药品,注意用高锰酸钾时,在试管口放一团棉花)→定(用铁架台固定仪器装置)→点(用火柴点燃酒精灯,给试管加热)→收(收集氧气)→移(把导管移出水面)→熄(熄灭酒精灯),可得题中正确的操作顺序是④⑦③⑤②①⑥;故填:A;
用排水法收集氧气时,应等到导管口的气泡连续均匀冒出时才能收集;故填:等到导管口的气泡连续均匀冒出;
③加热高锰酸钾制取氧气时,为了防止高锰酸钾颗粒进入导气管,需要在试管口放置一团棉花;故填:防止高锰酸钾颗粒进入导气管;
(5)高锰酸钾制取氧气需要加热,且生成物除氧气外,还有锰酸钾和二氧化锰;而过氧化氢在二氧化锰的催化作用下在常温下就可以生成水和氧气,对比而言后者既节能,又环保,故实验室制取氧气的反应物最好用过氧化氢;故填:过氧化氢。

【题目】把4 g硫粉放在给定质量的氧气中燃烧,有关实验数据如下表所示。
| 第一次 | 第二次 | 第三次 |
氧气的质量(g) | 3 | 4 | 6 |
SO2的质量(g) | 6 |
|
|
请回答下列问题:
(1)第一次实验中参加反应的硫的质量、氧气的质量与生成二氧化硫的质量比是________;
(2)请你通过计算,求出第二次实验生成二氧化硫的质量_______;
(3)在表中填写第三次生成的二氧化硫的质量_______。
【题目】材料一:候德榜是我国著名的化学家,发明了侯氏制碱法,为纯碱和氮肥工业技术的发展作出了杰出的贡献。下面是实验室模拟侯氏制碱法原理的生产过程:

①20℃时,将CO2通入含NH3的饱和NaCl溶液中,生成 NaHCO3晶体和NH4Cl溶液。
②将①中的产物 NaHCO3晶体充分加热分解,得到Na2CO3、H2O和CO2。
材料二:20℃时几种物质在水中的溶解度/g
NaCl | NH4Cl | NaHCO3 |
36.0 | 37.2 | 9.6 |
请回答下列问题:
(1)在第①步反应中,有 NaHCO3晶体析出,而没有NH4Cl和NaCl晶体析出的原因是_____。
(2)该生产过程中部分生成物可作为原料循环使用的是_____,同时得到的副产品NH4Cl是一种氮肥。