题目内容
(2009?肇庆)兴趣小组的同学在开展“废物利用、减少污染”的活动中,取某工厂合金废料(含铝、铁、铜)进行如下实验:
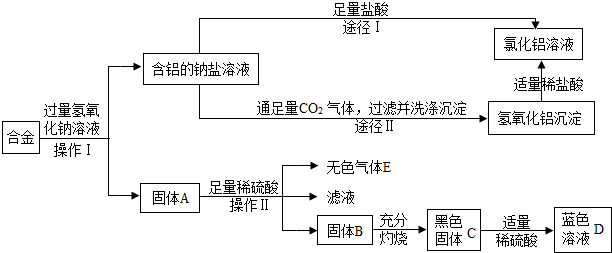
(1)操作Ⅰ的名称是
(2)固体A的成分是
(3)黑色固体C加适量稀硫酸反应的方程式为
(4)图中由含铝的钠盐制备氯化铝有两种途径,你认为合理的途径是

(1)操作Ⅰ的名称是
过滤
过滤
;该操作需用到的铁制仪器为铁架台(带铁圈)
铁架台(带铁圈)
.(2)固体A的成分是
铁、铜(或Fe、Cu);
铁、铜(或Fe、Cu);
;操作Ⅱ反应的化学方程式为Fe+H2SO4=FeSO4+H2↑
Fe+H2SO4=FeSO4+H2↑
.(3)黑色固体C加适量稀硫酸反应的方程式为
CuO+H2SO4=CuSO4+H2O
CuO+H2SO4=CuSO4+H2O
.(4)图中由含铝的钠盐制备氯化铝有两种途径,你认为合理的途径是
Ⅱ
Ⅱ
(填:“Ⅰ”或“Ⅱ”),理由是途径Ⅱ没有引入新的杂质,得到的是纯净的氯化铝溶液(或途径Ⅰ引入的杂质钠盐,得到的氯化铝不是纯净.合理表述均可)
途径Ⅱ没有引入新的杂质,得到的是纯净的氯化铝溶液(或途径Ⅰ引入的杂质钠盐,得到的氯化铝不是纯净.合理表述均可)
.分析:(1)操作I是分离固体与液体的操作应该是过滤操作.
(2)由D是蓝色溶液可知溶液中含有铜离子,则黑色固体是氧化铜,则固体B是单质的铜,由废料的成分可知固体A是单质的铁.
(3)该反应是氧化铜与硫酸的反应.
(4)从制备过程中是否会引入杂质分析考虑.
(2)由D是蓝色溶液可知溶液中含有铜离子,则黑色固体是氧化铜,则固体B是单质的铜,由废料的成分可知固体A是单质的铁.
(3)该反应是氧化铜与硫酸的反应.
(4)从制备过程中是否会引入杂质分析考虑.
解答:解:由转化情况分析可知废料中的铝能和氢氧化钠反应生成含铝的钠盐,所以固体A中一定含有铁与铜,其中铁与硫酸可反应生成氢气,铜不反应,铜灼烧会生成黑色的氧化铜,氧化铜与硫酸反应会生成硫酸铜的蓝色溶液;途径I中没有去除钠盐的成分,而途径II则是让铝转化成了沉淀氢氧化铝,去除了钠盐,氢氧化铝与盐酸发生中和反应生成的氯化铝更纯净一些.
(1)操作I是分离固体与液体的操作应该是过滤,所用到的仪器有铁架台,三角架等.
(2)由D是蓝色溶液可知溶液中含有铜离子,则黑色固体是氧化铜,则固体B是单质的铜,合金与氢氧化钠反应后生成含铝的钠盐,则固体A中一定有铁与铜,因此可知固体A中的单质铁能与硫酸反应生成氢气,而铜不能.
(3)单质的铜灼烧会生成氧化铜,氧化铜与硫酸反应生成硫酸铜与水.
(4)途径I在反应过程中没有去除钠盐,所以制备的氯化铝中含有钠盐,而II能去除钠盐,所以氯化铝更纯净.
故答案为:(1)过滤;铁架台(带铁圈)、或三角架;(2)铁、铜(或Fe、Cu);Fe+H2SO4=FeSO4+H2↑
(3)CuO+H2SO4=CuSO4+H2O
(4)Ⅱ;途径Ⅱ没有引入新的杂质,得到的是纯净的氯化铝溶液(或途径Ⅰ引入的杂质钠盐,得到的氯化铝不是纯净.合理表述均可)
(1)操作I是分离固体与液体的操作应该是过滤,所用到的仪器有铁架台,三角架等.
(2)由D是蓝色溶液可知溶液中含有铜离子,则黑色固体是氧化铜,则固体B是单质的铜,合金与氢氧化钠反应后生成含铝的钠盐,则固体A中一定有铁与铜,因此可知固体A中的单质铁能与硫酸反应生成氢气,而铜不能.
(3)单质的铜灼烧会生成氧化铜,氧化铜与硫酸反应生成硫酸铜与水.
(4)途径I在反应过程中没有去除钠盐,所以制备的氯化铝中含有钠盐,而II能去除钠盐,所以氯化铝更纯净.
故答案为:(1)过滤;铁架台(带铁圈)、或三角架;(2)铁、铜(或Fe、Cu);Fe+H2SO4=FeSO4+H2↑
(3)CuO+H2SO4=CuSO4+H2O
(4)Ⅱ;途径Ⅱ没有引入新的杂质,得到的是纯净的氯化铝溶液(或途径Ⅰ引入的杂质钠盐,得到的氯化铝不是纯净.合理表述均可)
点评:此题是一道推断分析题,解题的关键是掌握一些物质的特有性质,如溶液的颜色等.

练习册系列答案
相关题目