题目内容
【题目】某纯碱样品中含有杂质NaCl,为测定该样品中Na2CO3的质量分数,称取纯碱样品15g,向其中逐渐加入稀盐酸,如图是产生的气体质量与加入稀盐酸质量的关系图. 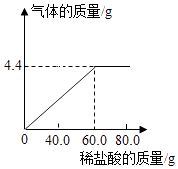
(1)样品中Na2CO3的质量分数是;
(2)恰好反应后所得溶液中溶质的质量分数;(写出计算过程,结果保留一位小数)
(3)当加入稀盐酸80.0g时,所得溶液中Na+的质量为 . (结果保留一位小数)
【答案】
(1)707%
(2)解:设生成4.4g二氧化碳需要的碳酸钠的质量为x,生成的氯化钠的质量为y.
Na2CO3+2HCl═ | 2NaCl+H2O+ | CO2↑ |
106 | 117 | 44 |
x | y | 4.4g |
![]() =
= ![]() =
= ![]()
x=10.6g
y=11.7g
样品中碳酸钠的质量分数为 ![]() ×100%≈70.7%
×100%≈70.7%
所得溶液中氯化钠的质量为11.7g+(15g﹣10.6g)=16.1g
其中含有的钠离子的质量为16.1g× ![]() ×100%≈6.3g
×100%≈6.3g
恰好反应所得溶液中氯化钠的质量分数为 ![]() ×100%≈22.8%
×100%≈22.8%
(3)6.3g
【解析】解:设生成4.4g二氧化碳需要的碳酸钠的质量为x,生成的氯化钠的质量为y.
Na2CO3+2HCl═ | 2NaCl+H2O+ | CO2↑ |
106 | 117 | 44 |
x | y | 4.4g |
![]() =
= ![]() =
= ![]()
x=10.6g
y=11.7g
样品中碳酸钠的质量分数为 ![]() ×100%≈70.7%
×100%≈70.7%
所得溶液中氯化钠的质量为11.7g+(15g﹣10.6g)=16.1g
其中含有的钠离子的质量为16.1g× ![]() ×100%≈6.3g
×100%≈6.3g
恰好反应所得溶液中氯化钠的质量分数为 ![]() ×100%≈22.8%
×100%≈22.8%
答:(1)样品中Na2CO3的质量分数是 707%;(2)恰好反应后所得溶液中溶质的质量分数为22.8%;(3)当加入稀盐酸80.0g时,所得溶液中Na+的质量为6.3g.
根据图可以看出生成的二氧化碳的质量为4.4g,根据二氧化碳的质量和对应的化学方程式可以求算碳酸钠的质量和生成的氯化钠的质量,进而确定所得溶液中氯化钠的总质量,最后求算所得溶液中氯化钠的质量分数.最后求算钠离子其实在盐酸加入到60.0g已经确定钠离子的多少,后期对钠离子多少不影响.