题目内容
下列变化不属于初中四种基本反应类型的是( )
A. CO2+Ca(OH)2═CaCO3↓+H2O
B. H2SO4+Zn═ZnSO4+H2↑
C. 3Fe+2O2  Fe3O4
Fe3O4
D. CaCO3 CO2↑+CaO
CO2↑+CaO
某实验小组同学对铁粉和氧化铜的混合物与足量的稀硫酸混合后,体系中各反应的先后顺序进行研究。
氧化铜与稀硫酸反应的化学方程式为________________。
(进行实验)以下实验中所用硫酸都是过量的。
实验1:将铁粉和氧化铜的混合物与60mL、10%稀硫酸混合,实验记录如下。
序号 | 铁粉/g | 氧化铜/g | 实验现象 |
1-1 | 0.56 | 1.6 | 立即出现红色固体,无气泡产生,充分反应后溶液呈蓝色 |
1-2 | 1.12 | 1.6 | 立即出现红色固体,无气泡产生,充分反应后溶液呈浅绿色 |
1-3 | 1.68 | 1.6 | 立即出现红色固体,待红色固体不再增加后产生大量气泡,充分反应后溶液呈浅绿色 |
实验2:将1.12g铁粉和1.6g氧化铜的混合物与30mL不同浓度的硫酸混合,实验记录如下。
序号 | 硫酸浓度/% | 实验现象 |
2-1 | 20 | 立即出现红色固体,无气泡产生,充分反应后溶液呈浅绿色 |
2-2 | 30 | 立即出现红色固体,瞬间产生大量气泡,充分反应后溶液呈浅蓝色 |
2-3 | 50 | 立即出现红色固体,瞬间产生大量气泡,反应过程中生成红色固体的同时持续产生细小气泡,充分反应后溶液呈浅蓝色 |
(解释与结论)
(1)浅绿色溶液中一定含有的溶质是H2SO4、____。
(2)实验中出现红色固体反应的化学方程式为_________;
(3)依据实验1推测,在稀硫酸浓度为10%,且硫酸足量的条件下,铁粉、氧化铜与稀硫酸反应的先后顺序为________。
(4)对比分析实验1-2与1-3,解释实验1-2没有产生气泡的原因______。
(5)在实验1-3中,产生氢气的质量最多为____ g。
(6)根据实验2判断,下列说法不正确的是____(填字母序号)。
A 硫酸浓度为20%,CuO先于Fe与硫酸反应
B 硫酸浓度为40%,Fe将先于CuO与硫酸反应
C 硫酸浓度为50%,Fe与CuSO4反应的同时也与硫酸反应


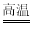 Cu+CO2
Cu+CO2
