题目内容
氯酸钾和二氧化锰共热制取氧气,已知反应前混合物共15.5g,反应完全后剩余固体10.7g,问分解出氧气多少克?剩余固体混合物中二氧化锰多少克?
【答案】分析:反应前后固体质量差即为生成氧气的质量,根据氧气的质量利用化学方程式求出氯酸钾的质量,然后求出二氧化锰的质量.
解答:解:设氯化钾的质量为X
根据质量守恒定律氧气质量为15.5g-10.7g=4.8g
2KClO3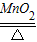 2KCl+3O2↑
2KCl+3O2↑
2×(39+35.5)=149 96
X 4.8g
 =
=
解之得:X=7.45g
所以二氧化锰质量为10.7g-7.45g=3.25g
答:分解出4.8g氧气,剩余固体混合物中二氧化锰为3.25g
点评:根据化学方程式进行计算,关键步骤要规范,一般步骤为设出未知数,写出配平的化学方程式,标出相关物质的质量比,列出比例式,求解,答,共六步.
解答:解:设氯化钾的质量为X
根据质量守恒定律氧气质量为15.5g-10.7g=4.8g
2KClO3
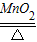 2KCl+3O2↑
2KCl+3O2↑2×(39+35.5)=149 96
X 4.8g
 =
=
解之得:X=7.45g
所以二氧化锰质量为10.7g-7.45g=3.25g
答:分解出4.8g氧气,剩余固体混合物中二氧化锰为3.25g
点评:根据化学方程式进行计算,关键步骤要规范,一般步骤为设出未知数,写出配平的化学方程式,标出相关物质的质量比,列出比例式,求解,答,共六步.

练习册系列答案
相关题目