题目内容
(2006?内江)甲、乙、丙三位同学在电解蒸馏水时,发现电极上几乎无气泡产生,但加入少量稀硫酸后产生气泡的速度明显加快.
[提出问题]:硫酸在电解水时起什么作用?
[猜想]:①电解后溶质的化学性质没有改变
②电解后溶质的化学性质完全改变
③电解后溶质的质量没有改变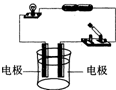
④电解后溶质的质量发生改变.
[实验]:如图所示,在烧杯中装100mL蒸馏水,接通电源,灯泡几乎不亮,电极上几乎无气泡产生.再加入50g质量分数为30%的稀硫酸,灯泡变亮,电极上产生大量气泡.持续电解一段时间后,把溶液均分为A、B、C三等份.
甲同学将A溶液分别与下列物质作用,记录如下:
说明猜想
乙同学向B溶液中加入过量的NaHCO3浓溶液,将产生的
因为
[结论]:电解水时加入硫酸溶液,硫酸起增强导电性的作用,其化学性质和溶质的质量不变.
[提出问题]:硫酸在电解水时起什么作用?
[猜想]:①电解后溶质的化学性质没有改变
②电解后溶质的化学性质完全改变
③电解后溶质的质量没有改变

④电解后溶质的质量发生改变.
[实验]:如图所示,在烧杯中装100mL蒸馏水,接通电源,灯泡几乎不亮,电极上几乎无气泡产生.再加入50g质量分数为30%的稀硫酸,灯泡变亮,电极上产生大量气泡.持续电解一段时间后,把溶液均分为A、B、C三等份.
甲同学将A溶液分别与下列物质作用,记录如下:
| 实验方法 | 现象 | 结论 |
| 与BaCl2、盐酸混合液作用 | 有白色沉淀产生 | A溶液有 SO42- SO42- 离子 |
| 与Zn粒作用,将产生的气体点燃 | 火焰呈淡蓝色 | A溶液有 H+ H+ 离子 |
| 与紫色石蕊试液作用 | 紫色石蕊试液变为 红 红 色 |
A溶液显酸性 |
①
①
正确(填序号).乙同学向B溶液中加入过量的NaHCO3浓溶液,将产生的
CO2
CO2
气体(假设产生的气体全部逸出)通入足量的澄清石灰水,所得沉淀经洗涤、干燥后,称得其质量为m1,由此算出B中阳离子质量为m2.上述实验中,判断NaHCO3溶液过量的方法是向B溶液中滴加NaHCO3溶液,若无气泡产生,表明NaHCO3溶液已过量
向B溶液中滴加NaHCO3溶液,若无气泡产生,表明NaHCO3溶液已过量
.丙同学向C溶液中加入过量的BaCl2溶液,过滤并洗涤沉淀,洗涤的方法为用蒸馏水将沉淀浸没后过滤,并重复2~3次
用蒸馏水将沉淀浸没后过滤,并重复2~3次
,沉淀干燥后称得其质量为m3,由此算出C中阴离子质量为m4.因为
m2+m4=15g
m2+m4=15g
(填含有字母的等式),所以猜想③正确,猜想④不正确.[结论]:电解水时加入硫酸溶液,硫酸起增强导电性的作用,其化学性质和溶质的质量不变.
分析:离子的检验中:一般用钡离子来检验硫酸根离子;用指示剂或金属检验氢离子;碳酸根离子用氢离子检验;二氧化碳用石灰水检验.混合物的分离方法有:过滤、蒸发、蒸馏等.有关的计算要正确.
解答:解:甲同学:与BaCl2、盐酸混合液作用,有白色沉淀产生,说明有钡离子;与Zn粒作用,将产生的气体点燃,火焰呈淡蓝色,说明有氢离子; 与紫色石蕊试液作用,紫色石蕊试液变为红色,说明溶液显酸性,因此猜想①是正确的.故答案为:SO42-; H+; 红;①;
乙同学:向B溶液中加入过量的NaHCO3浓溶液,将产生的二氧化碳气体;判断NaHCO3溶液过量的方法是:向B溶液中滴加NaHCO3溶液,若无气泡产生,表明NaHCO3溶液已过量.故答案为:CO2;向B溶液中滴加NaHCO3溶液,若无气泡产生,表明NaHCO3溶液已过量(其他合理答案也给分);
丙同学:向C溶液中加入过量的BaCl2溶液,生成白色沉淀硫酸钡,洗涤的方法为:用蒸馏水将沉淀浸没后过滤,并重复2~3次;计算出B中阳离子质量(即氢离子质量)为m2,C中阴离子(即硫酸根离子)质量为m4.当m2+m4=50g×30%=15g,所以猜想③正确,猜想④不正确.故答案为:用蒸馏水将沉淀浸没后过滤,并重复2~3次;m2+m4=15g
乙同学:向B溶液中加入过量的NaHCO3浓溶液,将产生的二氧化碳气体;判断NaHCO3溶液过量的方法是:向B溶液中滴加NaHCO3溶液,若无气泡产生,表明NaHCO3溶液已过量.故答案为:CO2;向B溶液中滴加NaHCO3溶液,若无气泡产生,表明NaHCO3溶液已过量(其他合理答案也给分);
丙同学:向C溶液中加入过量的BaCl2溶液,生成白色沉淀硫酸钡,洗涤的方法为:用蒸馏水将沉淀浸没后过滤,并重复2~3次;计算出B中阳离子质量(即氢离子质量)为m2,C中阴离子(即硫酸根离子)质量为m4.当m2+m4=50g×30%=15g,所以猜想③正确,猜想④不正确.故答案为:用蒸馏水将沉淀浸没后过滤,并重复2~3次;m2+m4=15g
点评:本考点属于实验探究题,既有离子的鉴别又有金属的性质和酸、碱、盐的性质,综合性比较强.本题根据题目提供的信息,结合课本中学过的知识来解决,还要注意混合物的分离方法和有关的计算.本考点主要出现在实验题中.

练习册系列答案
相关题目