题目内容
某学生用2.45g氯酸钾制氧气,在实验中加入了一定的高锰酸钾,反应完毕后,共收集到氧气4.96g,问加入的高锰酸钾是多少克?
解:2.45g氯酸钾分解所生成的氧气的质量为:2.45g× ×100%=0.96g
×100%=0.96g
高锰酸钾分解所生成的氧气质量为:4.96g-0.96g=4g
设加入高锰酸钾的质量为x.
2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
316 32
x 4g
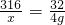
x=39.5g
答:加入高锰酸钾的质量为39.5g.
分析:根据氯酸钾分解的化学方程式和质量守恒定律氯酸钾中的氧元素全部生成了氧气,可以计算出2.45g氯酸钾所生成的氧气的质量;共收集到氧气4.96g减去2.45g氯酸钾所生成的氧气的质量就是高锰酸钾分解所生成的氧气质量;根据高锰酸钾分解所生成的氧气质量可计算出加入高锰酸钾的质量;
点评:本题主要考查有关化学方程式的计算,难度较小.
 ×100%=0.96g
×100%=0.96g高锰酸钾分解所生成的氧气质量为:4.96g-0.96g=4g
设加入高锰酸钾的质量为x.
2KMnO4
 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑316 32
x 4g
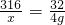
x=39.5g
答:加入高锰酸钾的质量为39.5g.
分析:根据氯酸钾分解的化学方程式和质量守恒定律氯酸钾中的氧元素全部生成了氧气,可以计算出2.45g氯酸钾所生成的氧气的质量;共收集到氧气4.96g减去2.45g氯酸钾所生成的氧气的质量就是高锰酸钾分解所生成的氧气质量;根据高锰酸钾分解所生成的氧气质量可计算出加入高锰酸钾的质量;
点评:本题主要考查有关化学方程式的计算,难度较小.

练习册系列答案
相关题目