题目内容
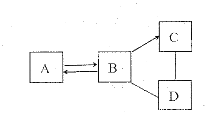
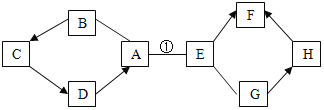
【题目】为了达到节能减排的目的,从含有金属镁、铁、铜的粉末中,分离和提取出重要化工原料![]() 和有关的金属,实验过程如下:
和有关的金属,实验过程如下:

![]() 步骤①得到的金属A是______;金属B是______。
步骤①得到的金属A是______;金属B是______。
![]() 在操作a过程中需要使用玻璃棒,其作用是_______
在操作a过程中需要使用玻璃棒,其作用是_______
![]() 写出步骤②所涉及的化学反应方程式:______,该反应发生的基本类型是:______。
写出步骤②所涉及的化学反应方程式:______,该反应发生的基本类型是:______。
![]() 实验步骤②中除了加入稀硫酸外,还可选用下列试剂______
实验步骤②中除了加入稀硫酸外,还可选用下列试剂______![]() 填标号
填标号![]() 。
。
![]() 硫酸铜溶液
硫酸铜溶液 ![]() 硫酸亚铁溶液
硫酸亚铁溶液 ![]() 硝酸银溶液
硝酸银溶液
【答案】铁 铜 引流 Mg+H2SO4=MgSO4+H2↑ 置换反应 ab
【解析】
(1)步骤![]() 中,铁能被磁铁吸引,因此得到的金属A是铁;镁和稀硫酸反应生成硫酸镁和氢气,铜不能和稀硫酸反应,因此金属B是铜。故填:铁;铜;
中,铁能被磁铁吸引,因此得到的金属A是铁;镁和稀硫酸反应生成硫酸镁和氢气,铜不能和稀硫酸反应,因此金属B是铜。故填:铁;铜;
(2)操作a是过滤,过程中需要使用玻璃棒,其作用是引流。故填:引流;
(3)步骤![]() 中镁和稀硫酸反应生成硫酸镁和氢气,反应的化学反应方程式为:Mg+H2SO4=MgSO4+H2↑,是置换反应。故填:Mg+H2SO4=MgSO4+H2↑;置换反应;
中镁和稀硫酸反应生成硫酸镁和氢气,反应的化学反应方程式为:Mg+H2SO4=MgSO4+H2↑,是置换反应。故填:Mg+H2SO4=MgSO4+H2↑;置换反应;
(4)实验步骤![]() 中除了加入稀硫酸外,还可选用下列试剂中的硫酸铜溶液、硫酸亚铁溶液,这是因为镁和硫酸铜反应生成硫酸镁和铜,和硫酸亚铁反应生成硫酸镁和铁,铜与硫酸铜、硫酸亚铁都不反应。故填:ab。
中除了加入稀硫酸外,还可选用下列试剂中的硫酸铜溶液、硫酸亚铁溶液,这是因为镁和硫酸铜反应生成硫酸镁和铜,和硫酸亚铁反应生成硫酸镁和铁,铜与硫酸铜、硫酸亚铁都不反应。故填:ab。

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案【题目】请从A或B两题中任选一个作答,若两题均作答,按A计分。
A | B |
|
|
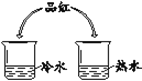
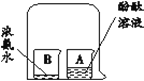
从微粒角度解释: (1)品红在水中扩散的原因是______。 (2)品红在热水中扩散速度快,其原因是______。 | (1)实验现象是______。 (2)实验结论是______。 |
【题目】为了探究相同条件下同种溶质在不同溶剂中的溶解性,某兴趣小组同学进行如下实验。(提示:本实验汽油与碘均不发生化学反应)
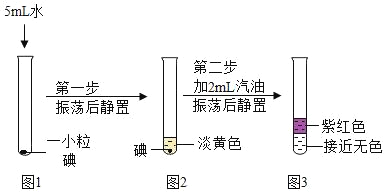
实验:碘在不同溶剂中的溶解实验根据实验操作图示回答相关问题。
实验操作图示 | 实验结论或解释 |
| (1)由图 2 所示现象可知:碘___ (选填“不”、“微”、或“易”)溶于水 (2)图3所示试管中液体分层。上层紫红色溶液的名称是___。说明碘在汽油中的溶解性比在水中___(选填“强”或“弱”) |
(反思与应用)
(3)①碘易溶于酒精。若实验中汽油用酒精代替,振荡后静置,最终所得液体___(选填“分层”或“不分层”)。
②“从稀碘水巾提取碘”是“海带提碘”工艺巾的一个重要步骤,其原理类似实验中第二步操作。工业实际生产时使用其他挥发性液体代替汽油,这种挥发性液体必须具备的条件是___。