题目内容
某校科学兴趣小组为测定某样品中氯化铵的质量分数,将6g样品溶于18g水后,再加入7.6g氢氧化钠浓溶液共热,两者恰好完全反应(样品中的杂质不与氢氧化钠反应,也不溶于水.)把产生的所有NH3用足量的硫酸溶液完全吸收,同时测量120秒内硫酸溶液增加的质量,结果如下表所示.
| 时间/s | 0 | 20 | 30 | 40 | 60 | 80 | 100 | 120 |
| 硫酸溶液增加的质量/g | 0 | 0.7 | 1.0 | 1.2 | 1.5 | 1.6 | 1.7 | 1.7 |
试回答下列问题:
(1)样品中氯化铵的质量分数;
(2)求反应后所得氯化钠溶液的溶质质量分数(不考虑反应过程中水分的损失).
解:(1)根据测定数据表中的时间与质量数据可以知道硫酸当增重到1.7g时质量不再增加,所以生成氨气的质量是1.7g;
放出1.7g氨气消耗氯化铵的质量为x,生成氯化钠的质量为y,则:
NH4Cl+NaOH NaCl+H2O+NH3↑
NaCl+H2O+NH3↑
53.5 58.5 17
x y 1.7g

解得:x=5.35g,y=5.85g,
样品中氯化铵的质量分数= ×100%≈89.2%;
×100%≈89.2%;
(2)所以反应后氯化钠溶液的质量=18g+6g+7.6g-1.7g-(6g-5.35g)=29.25g;则氯化钠溶液的质量分数为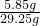 ×100%=20%.
×100%=20%.
答:(1)样品中氯化铵的质量分数为89.2%;
(2)反应后所得氯化钠溶液的溶质质量分数为20%;
分析:(1)依据图表的数据特点得到生成的氨气的质量,根据反应的化学方程式,由生成氨气的质量计算出样品中氯化铵的质量,利用物质的质量分数的计算公式计算氯化铵的质量分数;
(2)根据反应的化学方程式,由生成氨气的质量计算反应生成氯化钠的质量,利用溶液中溶质的质质量分数的计算公式求算出硝酸钠的质量分数即可.
点评:本题关键是计算出反应后的溶液的质量,根据质量守恒定律,反应后所得硝酸钠溶液的质量=样品质量+溶解所加水的质量+氢氧化钠浓溶液的质量-反应放出氨气的质量-样品中的杂质的质量.
放出1.7g氨气消耗氯化铵的质量为x,生成氯化钠的质量为y,则:
NH4Cl+NaOH
 NaCl+H2O+NH3↑
NaCl+H2O+NH3↑53.5 58.5 17
x y 1.7g

解得:x=5.35g,y=5.85g,
样品中氯化铵的质量分数=
 ×100%≈89.2%;
×100%≈89.2%;(2)所以反应后氯化钠溶液的质量=18g+6g+7.6g-1.7g-(6g-5.35g)=29.25g;则氯化钠溶液的质量分数为
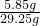 ×100%=20%.
×100%=20%.答:(1)样品中氯化铵的质量分数为89.2%;
(2)反应后所得氯化钠溶液的溶质质量分数为20%;
分析:(1)依据图表的数据特点得到生成的氨气的质量,根据反应的化学方程式,由生成氨气的质量计算出样品中氯化铵的质量,利用物质的质量分数的计算公式计算氯化铵的质量分数;
(2)根据反应的化学方程式,由生成氨气的质量计算反应生成氯化钠的质量,利用溶液中溶质的质质量分数的计算公式求算出硝酸钠的质量分数即可.
点评:本题关键是计算出反应后的溶液的质量,根据质量守恒定律,反应后所得硝酸钠溶液的质量=样品质量+溶解所加水的质量+氢氧化钠浓溶液的质量-反应放出氨气的质量-样品中的杂质的质量.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目