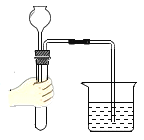
题目内容
【题目】如图为硫酸性质的知识归纳,下列表达不正确的是( )

A.若盐为BaCl2的溶液,则反应中有白色沉淀生成
B.若碱为NaOH的溶液,可以通过检测溶液中的pH变化情况,证明两者发生了中和反应
C.若金属氧化物为Fe2O3,可以利用硫酸与金属氧化物反应的这一性质,除去铁锈
D.若金属为Mg,则反应后的溶液呈浅绿色
【答案】D
【解析】
A、若盐为BaCl2的溶液,则氯化钡与硫酸反应产生硫酸钡白色沉淀;故选项正确,但不符合题意;
B、若碱为NaOH的溶液,硫酸与氢氧化钠反应产生硫酸钠和水,可以通过检测溶液中的pH变化情况,证明两者发生了中和反应;故选项正确,但不符合题意;
C、若金属氧化物为Fe2O3,硫酸与氧化铁反应产生硫酸铁和水,可以利用硫酸与金属氧化物反应的这一性质,除去铁锈;故选项正确,但不符合题意;
D、若金属为Mg,则镁和硫酸反应产生无色溶液硫酸镁和氢气;故选项错误,但符合题;
故选:D。

 金牌教辅培优优选卷期末冲刺100分系列答案
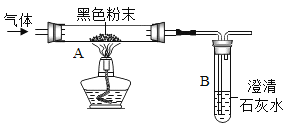
金牌教辅培优优选卷期末冲刺100分系列答案【题目】(1)定性检测(已知:无水CuSO4遇水变蓝色)
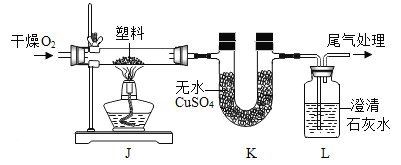
实验操作 | 实验现象 | 结论 |
连接上图所示装置,_____,装入试剂,一段时间后,点燃J处酒精灯。 | 装置K中无水CuSO4_____色; | 塑料燃烧产物中有H2O |
装置L中澄清石灰水变浑浊。 | 塑料燃烧产物中有_____ |
由上述实验可知,该塑料一定含有的元素是_____(填元素符)。
(2)定量测定
为进一步确定组成,将2.8g该塑料在足量O2中完全燃烧,共产生了8.8gCO2和3.6gH2O,依据质量守恒定律,可判断该塑料_____(填“含有”或“不含”)除上述④中结论之外的元素。
【题目】实验室有一瓶氢氧化钠固体,由于长时间放置已部分变质。某课外兴趣小组为测定该瓶粉末中碳酸钠的质量分数,他们称取20g固体样品放入锥形瓶,加水溶解配成100g溶液。将烧杯置于电子秤上,加入适量稀盐酸恰好完全反应,总质量与反应时间的关系如下表所示:
反应时间/秒 | 0 | 10 | 20 | 20 | 40 |
总质量/克 | 310.0 | 309.6 | 308.6 | 307.8 | 307.8 |
(1)完全反应后,生成的CO2气体的质量为_____克。
(2)计算出该样品中Na2CO3的质量分数_____(要有计算过程)。
(3)经过分析讨论,同学们觉得实验中有些因素可能会对测量结果有一定的影响,下列分析正确的是_____。(填字母序号)
A 稀盐酸有挥发性,挥发出氯化氢气体,可能导致最终结果偏大
B 二氧化碳逸出带走部分水蒸气,可能导致测量结果偏小
C 生成的二氧化碳溶解在反应后的溶液中一部分,可能导致测量结果偏小