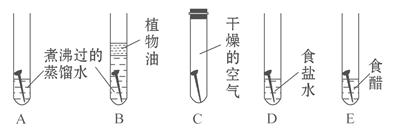
题目内容
人类的生产生活离不开金属.
(1)金属铁、铝常用来制作炊具,主要是利用其 性.
(2)人类每年从自然界提取大量的金属,其中提取量最大的是铁.赤铁矿(主要成分为Fe2O3)和一氧化碳炼铁的化学方程式为 .
(3)我国钢铁年产量很高,但因锈蚀造成的损失也很惊人.工业上常用稀盐酸除去铁锈,该反应的化学方程式为 .
(4)从含有CuSO4、ZnSO4、FeSO4的废水中回收重要原料硫酸锌和有关金属,实验过程如下.
请回答:
写出步骤①中发生反应的化学方程式 ;固体D的化学式为 ;以上物质A~G中,含有锌元素的是 (填字母序号)
(1)导热; (2)3CO+Fe2O3 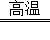 2Fe+3CO2;(3)6HCl+Fe2O3=2FeCl3+3H2O;
2Fe+3CO2;(3)6HCl+Fe2O3=2FeCl3+3H2O;
(4)Zn+FeSO4=Fe+ZnSO4 ;Zn+CuSO4=ZnSO4+Cu;Fe;ABCEG.
解析试题分析:(1)作炊具,主要是利用金属的导热性.(2)用赤铁矿(主要成分为Fe2O3)和一氧化碳炼铁的反应物是一氧化碳和氧化铁,写在等号的左边,生成物铁和二氧化碳写在等号的右边,根据得失氧进行配平,反应条件是高温写在等号的上边,所以化学方程式为:3CO+Fe2O3 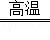 2Fe+3CO2.(3)盐酸除铁锈的反应物是盐酸和氧化铁写在等号的左边,生成物氯化铁和水写在等号的右边,用观察法配平即可,所以方程式是:6HCl+Fe2O3=2FeCl3+3H2O.(4)根过量A是加入的锌,锌与硫酸亚铁反应生成铁和硫酸锌,所以方程式是:Zn+FeSO4═Fe+ZnSO4;锌与硫酸铜反应生成铜和硫酸锌,所以方程式是:Zn+CuSO4═ZnSO4+Cu;由于锌与硫酸亚铁反应生成铁盒硫酸锌,锌与硫酸铜反应生成铜和硫酸锌,且加入的锌是过量的,所以固体B中含有锌、铁、铜;溶液C是硫酸锌溶液;固体B用磁铁把铁吸引出来,所以固体D是铁;固体E中含有锌和铜,由于锌能与硫酸反应,铜与硫酸不反应,所以加入的溶液F是稀硫酸,溶液G是硫酸锌溶液;所以含有锌元素的有ABCEG.
2Fe+3CO2.(3)盐酸除铁锈的反应物是盐酸和氧化铁写在等号的左边,生成物氯化铁和水写在等号的右边,用观察法配平即可,所以方程式是:6HCl+Fe2O3=2FeCl3+3H2O.(4)根过量A是加入的锌,锌与硫酸亚铁反应生成铁和硫酸锌,所以方程式是:Zn+FeSO4═Fe+ZnSO4;锌与硫酸铜反应生成铜和硫酸锌,所以方程式是:Zn+CuSO4═ZnSO4+Cu;由于锌与硫酸亚铁反应生成铁盒硫酸锌,锌与硫酸铜反应生成铜和硫酸锌,且加入的锌是过量的,所以固体B中含有锌、铁、铜;溶液C是硫酸锌溶液;固体B用磁铁把铁吸引出来,所以固体D是铁;固体E中含有锌和铜,由于锌能与硫酸反应,铜与硫酸不反应,所以加入的溶液F是稀硫酸,溶液G是硫酸锌溶液;所以含有锌元素的有ABCEG.
考点:金属的物理性质及用途;金属活动性顺序及其应用;一氧化碳还原氧化铁;酸的化学性质.

(7分)冬天,小方陪妈妈去医院打点滴,发现护士往输液管上放了一个纸包(如图所示),经询问得知它可以温暖输入人体中的液体。小方对包里的东西能产生热量感到很神奇,于是,他向护士要了一只用过的纸包,带回来进行了如下探究。
探究一:包里是什么物质。
他剪开纸包,发现里面是一些黑色粉末和暗红色粉末。
【提出猜想】纸包里的物质可能是炭粉、铁粉、氧化铁、氧化亚铁中某几种物质的混合物。
【查阅资料】氧化亚铁是一种黑色粉末,不溶于水。在空气中稍受热即被迅速氧化成四氧化三铁,铁的氧化物中只有四氧化三铁能被磁铁吸引。四氧化三铁与盐酸反应生成氯化亚铁、氯化铁和水。
【初步结论】根据资料知识,你认为纸包中的黑色粉末除了猜想物质以外,还可能含有 。
【进行实验】
| 实验编号 | 实验操作 | 实验现象 |
| ① | 将磁铁靠近粉末 | 黑色粉末部分被吸引,暗红色粉末不被吸引 |
| ② | 取少量粉末加入足量稀盐酸 | 有气泡产生,底部有黑色不溶物 |
⑵实验②中产生气泡的化学方程式是__________________________________________。
探究二:纸包为什么会放热。
【查阅资料】铁粉在空气中会发生缓慢氧化而放出热量,转化成氧化铁。
请你写出该反应的化学方程式 。
你若能正确完成下面的相关内容将奖励4分。但化学试卷总分不超过60分。
在上面的实验中还不能得出纸包中一定含有四氧化三铁。请你继续完成以下实验内容:
| 实验步骤 | 实验现象 | 结论 |
| | | 纸包中含有四氧化三铁。 |
下表是某种常见金属的部分性质:
| 颜色、状态 | 硬度 | 密度 | 熔点 | 导电性 | 导热性 | 延展性 |
| 银白色固体 | 较软 | 2.70g/cm3 | 660.4℃ | 良好 | 良好 | 良好 |
将该金属投入稀盐酸中,可产生大量的无色气体。根据上述信息回答以下问题:
推断该金属的一种用途__________;
金属的活动性比铜_______. (填“强”或“弱”);
请自选试剂,设计实验探究该金属与铁的活动性强弱.并完成下表.
| 你的一种猜想 | |
| 验证方法 | |
| 现象 | |
| 结论 | |