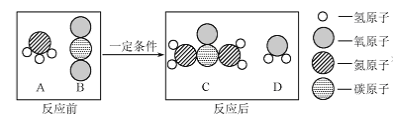
题目内容
【题目】(5分)海水中蕴含着80多种元素,海洋是一座巨大的宝库。氯碱工业以海水为原材料可以大量制取烧碱和氯气,它们都是重要的化工生产原料,可以进一步加工成多种化工产品,广泛用于工业生产。所以氯碱工业及相关产品几乎涉及国民经济及人民生活的各个领域。
(1)氯碱工业中发生反应的化学方程式为:2NaCl+2H2O=2NaOH+Cl2↑+A,则A的化学式为 。氯气常用于自来水的杀菌消毒,它与水反应生成盐酸和次氯酸(HClO),试写出该反应的化学方程式 。
(2)下图是甲、乙两种固体物质的溶解度曲线。
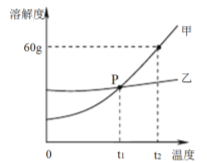
①P点的意义是 。
② 甲物质中含有少量乙物质,提纯甲物质可用 方法(选填“降温结晶”、“蒸发结晶”之一)。
③t2℃时,甲的饱和溶液中溶质的质量分数是 。
【答案】 (1)H2 Cl2+H2O=HCl+HClO (2)① 在t1℃,甲乙两物质溶解度相等 ② 降温结晶 ③ 37.5%
【解析】
试题分析:(1)氯碱工业中发生反应的化学方程式为:2NaCl+2H2O=2NaOH+Cl2↑+A,根据质量守恒定律,反应前后原子的种类和数量不变,则A的化学式为H2氯气常用于自来水的杀菌消毒,它与水反应生成盐酸和次氯酸(HClO),该反应的化学方程式Cl2+H2O=HCl+HclO;(2)由溶解度曲线图可知①P点的意义是在t1℃,甲乙两物质溶解度相等;② 甲物质中含有少量乙物质,提纯甲物质,根据溶解度曲线甲物质的溶解度随温度的升高而增大较大,故可用降温结晶的方法;③t2℃时,甲的饱和溶液中溶质的质量分数是![]() 37.5%。
37.5%。

【题目】研究和学习化学,有许多方法。下列方法中所举示例错误的是( )
选项 | 方法 | 示例 |
A | 实验法 | 用磷做“测定空气中氧气含量”的实验 |
B | 分类法 | 根据组成物质的元素种类,将纯净物分为单质和化合物 |
C | 归纳法 | 根据稀盐酸、稀硫酸等物质的化学性质,归纳出酸的通性 |
D | 类比法 | 根据金属铝能与稀盐酸反应,推测金属铜也能与稀盐酸反应 |
【题目】下列物质保存方法的原因正确的是:
选项 | 保存方法 | 原 因 |
A | 生石灰应密封保存 | 生石灰易与空气中的氧气反应 |
B | 浓盐酸应密封保存 | 浓盐酸在空气中易分解 |
C | 白磷应保存在水中 | 白磷有剧毒 |
D | 烧碱应密封保存 | 烧碱易潮解且与空气中二氧化碳反应 |
A. A B. B C. C D. D