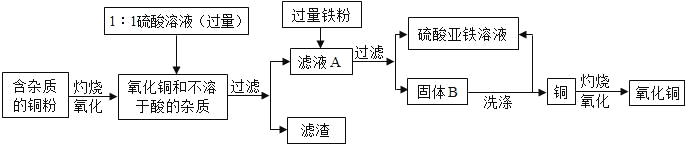
题目内容
【题目】有一包含有氧化铜和碳粉的黑色粉末,为了探究该粉末的组成,取10g黑色粉末加入到98g的稀硫酸中,恰好完全反应后得到残留固体质量为2g。试计算:
(1)10g粉末中氧化铜的质量为______g
(2)所用稀硫酸的溶质质量分数为_________?
【答案】8 ![]()
【解析】
氧化铜和稀硫酸生成硫酸铜和水,碳不会和稀硫酸反应;根据化学方程式计算硫酸的质量,进而求出所用稀硫酸的溶质质量分数。
(1)因为氧化铜和稀硫酸生成硫酸铜和水,其中硫酸铜溶液是蓝色溶液。碳不会和稀硫酸反应,残留的2g固体为碳,则10g粉末中氧化铜的质量为:10g-2g=8g;
(2)解:设参加反应的H2SO4质量为x,
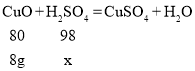
由![]() ,解得x=9.8 g,
,解得x=9.8 g,
所用稀硫酸的溶质质量分数=![]() =
=![]()
答:所用稀硫酸的溶质质量分数为![]() 。
。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】铁与水蒸气在高温条件下反应生成了一种铁的氧化物和一种气体单质,实验装罝如下图所示。
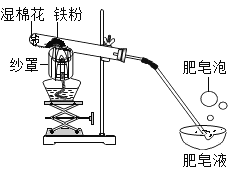
(1)试管尾部放一团湿棉花的目的是__________。
(2)用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到上方空气中。说明生成的气体是__________。
(3)探宄试管中剩余固体的成分。
(査阅资料)
①几种常见铁的氧化物的颜色、状态及能否被磁铁吸引如下表所示。
常见铁的氧化物 | FeO | Fe2O3 | Fe304 |
颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色品体 |
能否被磁铁吸引 | 否 | 否 | 能 |
②四氧化三铁能与稀硫酸反应:
Fe304+4H2SO4=FeSO4+Fe2(SO4)3+4H2O
(初步实验验证)
试管中剩余间体为黑色,能全部被磁铁吸引,则剩余固体一定不含氧化物__________、__________。
(猜想与假设)
猜想一:剩余固体是Fe304;
猜想二:剩余固体是__________。
(继续进行实验)
实验操作 | 实验现象 | 实验结论 |
取少量黑色固体于试管中,滴加足量的稀硫酸。 | _____________。 | 猜想一不成立, 猜想二成立。 |
(实验结论)铁和水蒸气反应的化学方程式为____________________。
【题目】某学校开展了如下“溶液酸碱性的检验”的实验活动.
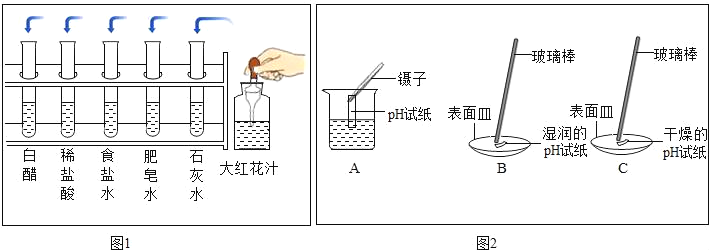
(1)把自制的大红花汁按图1所示分别滴加到试管中,观察到的现象如表所示:
试剂 | 白醋 | 稀盐酸 | 食盐水 | 肥皂水 | 石灰水 |
加入红花汁后的颜色 | 橙色 | 橙色 | 粉红色 | 绿色 | 绿色 |
①图1大红花汁_____(填“可以”或“不可以”)作酸碱指示剂.
②据上表推测,大红花汁遇到稀硫酸溶液显示的颜色是_____.
③取少量厨房清洁剂放入试管中,加入大红花汁,发现溶液变为绿色,得出厨房清洁剂显_____性.
(2)用pH试纸测得碳酸饮料的pH_____(填“>”、“<”、“=”)7.
(3)图2是三位同学分别测定肥皂水酸碱性的操作示意图,其中正确的是_____(填“A”、“B”、“C”,下同),可能导致肥皂水pH数值发生改变的错误操作是_____.