题目内容
利用如图所示的实验探究物质的性质,下列叙述错误的是( )

A. 若 溶液变红,
溶液变红, 无变化,则M可能为酚酞溶液
无变化,则M可能为酚酞溶液
B. 若只有 反应有明显现象,则M可能为稀盐酸
反应有明显现象,则M可能为稀盐酸
C. 若 都有沉淀生成,则M可能为氢氧化钡溶液
都有沉淀生成,则M可能为氢氧化钡溶液
D. 若 都没有现象,则M可能为氢氧化钠溶液
都没有现象,则M可能为氢氧化钠溶液
某实验小组用石墨做电极进行电解水实验,为增加导电性,改用氢氧化钙饱和溶液进行电解,实验时除两个电极均有气泡冒出外,在正极石墨电极的附近溶液中还出现了白色浑浊,该小组对白色浑浊出现的原因进行了如下探究。
[资料]
Ⅰ.氢氧化钙的溶解度曲线如图所示。

Ⅱ.氢氧化钙饱和溶液通电后温度约上升5℃。
[猜想]
①电解过程中溶液温度升高导致Ca(OH)2析出而出现白色浑浊。
②电解过程中水减少导致Ca(OH)2析出而出现白色浑浊。
③与石墨电极(主要成分是碳)有关。
[实验]
实验 | 实验装置 | 主要实验操作 | 实验现象 |
1 | 取10mL Ca(OH)2饱和溶液,稍加热,溶液温度上升5℃ | 溶液中未出现白色浑浊 | |
2 |
| 用石墨做电极,取Ca(OH)2饱和溶液于水槽中,通电2分钟 | a、b试管中都有气泡产生;a试管中溶液未出现白色浑浊;b试管中溶液明显出现白色浑浊 |
3 | 更换石墨电极为铜电极,取Ca(OH)2饱和溶液于水槽中,通电2分钟 | a、b试管中都有气泡产生;与电源正极相连的铜电极变墨,a、b试管中溶液未出现白色浑浊 |
(1)Ca(OH)2的溶液度随温度升高而__________(填“减少”或“增大”);实验1中当液温度上升5℃后得到的溶液为Ca(OH)2 __________(填“饱和”或“不饱和”)溶液。
(2)实验1得出的结论是___________________________________________________________。
(3)实验2,取b试管中白色浑浊溶液,加10mL水,振荡,发现试管中白色浑浊不溶解,据此证明猜想_______(填序号)不合理。
(4)实验3中更换石墨电极为铜电极的目的是__________________________________________;与电源正极相连的铜电极变黑的原因是_____________________________________________(用化学方程式表示);为除去铜电极上的黑色物质,需要的试剂是_____________(写一种即可)。
(5)通过探究过程,用石墨做电极进行实验时,正极石墨电极附近Ca(OH)2溶液出现白色浑浊的原因是__________________________________________________________________________。
某兴趣小组同学对CuSO4溶液与NaOH溶液反应生成的蓝色沉淀进行了相关探究。
(1)写出生成蓝色沉淀的反应方程式______。
(2)对蓝色沉淀进行加热,一般看到蓝色沉淀变黑色,可有时却看到蓝色沉淀变绿色,该兴趣小组对这异常现象产生了兴趣,决定对这现象产生的实验条件进行探究。
(查阅资料)难溶性碱受热易分解成对应的金属化合物,写出蓝色沉淀变黑色的化学方程式______。
(提出问题)加热蓝色沉淀不出现黑色沉淀,与什么因素有关?
(作出猜想)猜想一:与硫酸铜溶液过量有关
猜想二:与氢氧化钠溶液过量有关
(设计实验)限选试剂:1%的NaOH溶液,20%的NaOH溶液,20%的CuSO4溶液,1%的CuSO4溶液。
实验操作 | 实验现象 | 实验结论 |
(1) ______ 再将所得沉淀加热 | 先产生蓝色沉淀,加热后 ______ | 猜想一不成立 |
(2)往2mL 20%NaOH溶液中滴加2滴1%CuSO4溶液,再将所得沉淀加热 | ______ | 猜想二成立 |
(实验结论)在上述实验中,要能观察到蓝色沉淀变黑色的关键是______。
(拓展延伸)进一步查阅资料可知上述绿色物质是溶解度比氢氧化铜更小的碱式硫酸铜[化学式为Cu4(OH)6SO4],在碱性较强的条件下容易形成,继续加热一段时间该绿色固体则可产生黑色沉淀,请设计一个实验,证明该浅绿色沉淀中含有硫酸根离子______。


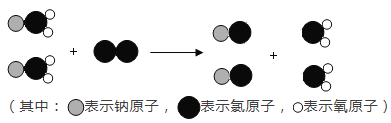

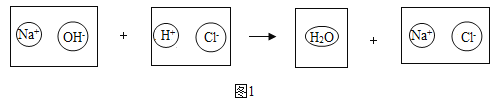
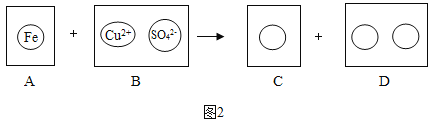

 熄灭酒精灯 B.
熄灭酒精灯 B. 闻气体气味 C.
闻气体气味 C. 滴加试剂 D.
滴加试剂 D. 倾倒液体
倾倒液体