题目内容
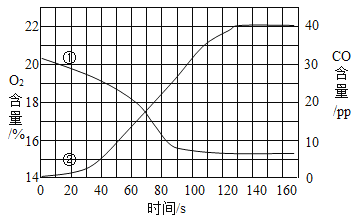
【题目】用质量相等的锌粉和铁粉分别与溶质质量分数相同、等质量的稀盐酸充分反应,产生氢气质量与所用时间的关系如图所示.则下列说法中与曲线相符合的是
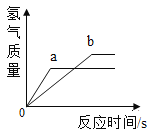
A.曲线a表示铁反应的情况
B.盐酸反应完毕,两种金属都有剩余
C.锌与盐酸反应完毕,刚好完全反应,铁有剩余
D.锌粉和铁粉都反应完毕,盐酸有剩余
【答案】D
【解析】
根据化学方程式:Zn+2HCl=ZnCl2+H2↑;Fe+2HCl═FeCl2+H2↑进行分析。
A、因为锌的活动性比铁的活动性强,生成等质量的氢气,锌反应的时间短,故曲线a表示锌反应的情况,故A说法错误;
B、如果盐酸均反应完,两种金属都有剩余,盐酸的质量相等,则生成的氢气质量应该相等,而图中氢气质量不等,故B说法错误;
C、如果锌与盐酸刚好完全反应,铁有剩余,说明盐酸完全反应,则产生的氢气一定相等,故C说法错误;
C、等质量的金属锌和铁,铁与酸反应生成的氢气质量多(等质量的+2价金属,生成氢气的质量与金属的相对原子质量成反比),所以该图像中锌粉和铁粉都反应完毕,盐酸有剩余,故D说法正确。
故选:D。

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案【题目】一包干燥的红色粉末,由 Cu 、Fe2O3 、Fe(OH)3三种固体中的一种或两种组成。下面是同学们的探究过程,请你参与并回答有关问题。
(提出猜想)
猜想①:只有 Cu
猜想②:只有Fe2O3
猜想③:只有 Fe(OH)3
猜想④:是Fe2O3 、Fe(OH)3的混合物
猜想⑤:是Cu 、Fe2O3的混合物
猜想⑥:是_______________的混合物
(查阅资料)(1)2Fe(OH)3![]() Fe2O3+3H2O
Fe2O3+3H2O
(2)Cu在FeCl3溶液中发生反应:2FeCl3+Cu=2FeCl2+CuCl2
(实验探究)
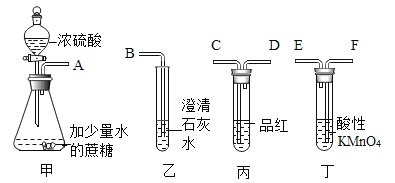
(1)甲同学进行下列实验,请你填写表中空白处。
实验操作步骤 | 实验现象 | 结论 |
①取用少量红色固体,放于试管中加热 | ____________ | 红色固体不含Fe(OH)3 |
②取少量红色末于试管中,滴加足量稀盐酸 | 发现固体全部溶解,溶液变色 | 猜想②或猜想______成立,猜想②成立时反应的化学方程式是____________。 |
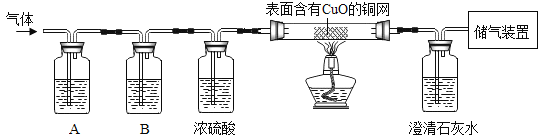
(2)在甲同学实验的基础上,乙同学为进一步确定红色粉末的组成,称取该粉末 8.0g 装入硬质玻璃管中,按如图装置进行实验。实验时发现澄清石灰水变浑浊,证明红色粉末中含有____________,硬质玻璃管中发生反应的化学方程式是________________。反应完全后测得石灰水质量增加5g(产生气体全部被稀释),则猜想_________成立。
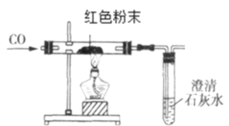
(反思评价)丙同学指出:从环保角度,乙同学的实验装置有严重不足之处。你认为改进的方法是________________。