题目内容
【题目】实验室废弃液中含一定量的AgNO3。兴趣小组同学回收金属银的流程如下: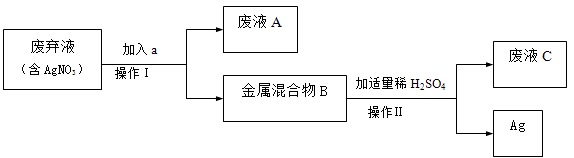
请认真分析以上流程,回答下列问题
(1)选择a。甲同学认为用铁,乙同学认为用铜,你认为(选填“甲”或“乙”)合理,则加入a发生反应的化学方程式是。金属混合物B所含的物质有(填化学式)。
(2)加入过量a的目的是。
(3)金属混合物B与H2SO4反应的化学方程式为。
(4)要验证Fe、Cu、Ag三种金属的活动顺序,下列选用的试剂能达到实验目的的是(填序号)。
①Fe、Cu、Ag、稀H2SO4 ②CuSO4溶液、Fe、Ag
③FeSO4溶液、Cu、Ag ④FeSO4溶液、Cu、AgNO3溶液
【答案】
(1)甲,Fe+2AgNO3=Fe(NO3)2+2Ag,Ag、Fe
(2)把AgNO3中的银全部置换出来
(3)Fe+H2SO4=FeSO4+H2↑
(4)②④
【解析】(1)由题意结合金属活动性顺序的应用可知,甲同学加入铁粉后得到的金属混合物B含有银和铁,下一步加稀硫酸易分离,所以科学合理;乙同学得到的金属混合物B含有银和铜,加稀硫酸两者均不能与之反应,所以不易分离,所以方案设计不合理,加入a是铁,发生反应的化学方程式是:Fe+2AgNO3═2Ag+Fe(NO3)2;(2)为能充分的置换出溶液中的银,可采用加入过量的铁粉进行实验;(3)由于加入过量的铁,铁与硝酸应反生成了银,所以金属混合物B的成分是铁和银,依据铁与稀硫酸能反应但银与稀硫酸不能反应的情况,金属混合物的铁能与与H2SO4反应,化学方程式为:Fe+H2SO4=FeSO4+H2↑。(4)①铜和银都不会与硫酸反应,铜和银活动性无法比较,故错误; ②铁会与硫酸铜反应,银不会与硫酸铜反应,说明铁比铜活泼,银没有铜活泼,故正确;③铜、银都不会与硫酸亚铁反应,铜、银活动性无法比较,故错误;④铜不会与硫酸亚铁反应,铜会与硝酸银反应,说明铁比铜活泼,铜比银活泼,故C正确。
【考点精析】解答此题的关键在于理解金属活动性顺序及其应用的相关知识,掌握在金属活动性顺序里:1、金属的位置越靠前,它的活动性就越强2、位于氢前面的金属能置换出盐酸、稀硫酸中的氢(不可用浓硫酸、硝酸)3、位于前面的金属能把位于后面的金属从它们的盐溶液中置换出来.(除K、Ca、Na),以及对书写化学方程式、文字表达式、电离方程式的理解,了解注意:a、配平 b、条件 c、箭号.

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案