题目内容
【题目】实验室一般用氢氧化钠溶液吸收二氧化碳或二氧化硫。已知二氧化碳过量时,氢氧化钠全部转化成碳酸钠后,还会发生以下反应;Na2CO3+ H2O+CO2=2NaHCO3
(1)现在实验室用含氢氧化钠4.0g的溶液吸收二氧化碳,最多能产生NaHCO3多少克?(写出计算过程)
(2)请在下图中画出产生碳酸氢钠的质量的变化曲线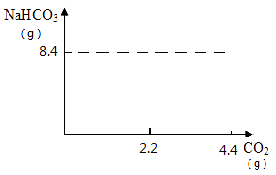
【答案】
(1)8.4g
(2)
【解析】解:(1)设实验室用含氢氧化钠4.0g的溶液吸收二氧化碳,最多能产生NaHCO3的质量为x
由方程式:2NaOH+CO2=Na2CO3+H2O, Na2CO3+ H2O+CO2=2NaHCO3 , 得关系式为
2NaOH ~ Na2CO3 ~ | 2NaHCO3 |
80 | 168 |
4.0g | x |
![]() =
=![]() x=8.4g;
x=8.4g;
(2) 由方程式可知,开始通入二氧化碳生成碳酸钠,碳酸钠和二氧化碳再反应生成碳酸氢钠,所以图像为: 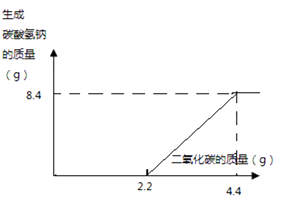
所以答案是:(1)8.4g;(2)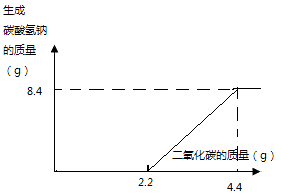
【考点精析】解答此题的关键在于理解根据化学反应方程式的计算的相关知识,掌握各物质间质量比=系数×相对分子质量之比.

练习册系列答案
相关题目