题目内容
【题目】学生甲称取一定质量的氯酸钾和2.0g二氧化锰,混合均匀后放入试管,加热制取氧气,当收集到所需氧气后即停止加热,试管冷却后称量,得知留下的反应混合物质量为5.94g然后学生乙将它继续加热直至氯酸钾完全分解,收集到的氧气为0.96g学生甲称取的氯酸钾是多少克?
【答案】4.9克
【解析】设生成0.96g氧气需要KClO3的质量是![]() 。
。
2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
245 96
x 0.96g
![]()
![]() =2.45g
=2.45g
∴5.94g剩余固体物质中含KCl的质量=5.94g-2.0g-2.45g=1.49g。设生成1.49gKCl需KClO3的质量是![]() 。
。
2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
245 149
![]() 1.49g
1.49g
![]()
![]() =2.45g
=2.45g
∴总的氯酸钾的质量=2.45g+2.45g=4.9g。
答:学生甲称取的氯酸钾是4.9g。

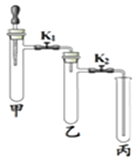
【题目】利用表中装置进行下列实验。
实验装置 | 实验1 | 实验2 |
| ①甲试管中放入少量MnO2,滴管中放入过氧化氢溶液,乙、丙中分别放入一小块白磷依次加入适量80℃的水,白磷均不燃烧 ②打开K1、K2,将过氧化氢溶液滴入试管,观察到乙试管中白磷不燃烧,丙中白磷燃烧 ③一段时间后,丙中导管内液 面上升 | ①关闭K1,打开K2,甲试管中充满CO2,滴管中放入浓NaOH溶液;乙试管中放入适量铁粉,丙中放入约半试管稀盐酸 ②将浓NaOH溶液滴入甲试管中,一段时间后,打开K1 ③一段时间后,观察乙、丙试管中的现象 |
(1)实验1:甲中发生反应的化学方程式是_______________,对比乙和丙中的实验现象,本实验欲探究的燃烧条件是_____________;步骤③中“丙中导管内液面上升”的原因是________________。
(2)实验2:甲中发生反应的化学方程式为____________;步骤③乙中的现象是_____________;丙试管中的现象是_________。
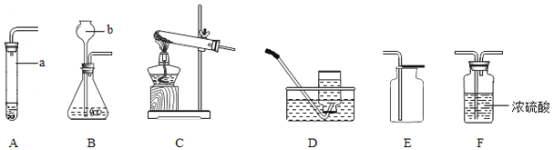
【题目】分液漏斗是化学实验室一种常用的仪器,可用于滴加液体或分离互不相溶的两种液体,实验室部分装置如A~D所示。
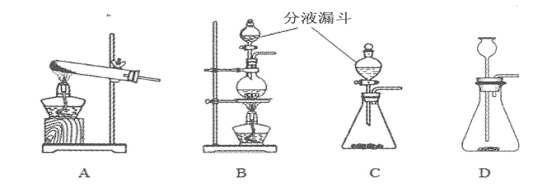
(1)实验室用KMnO4制取O2的化学方程式为 。
(2)实验室制取气体通过反应物状态,反应条件等选用相应的反应装置,请完成下表空格。
制取的气体 | 反应物 | 反应条件 | 反应装置(填字母) |
O2 | KClO3固体 | 催化剂MnO2固体、加热 | |
H2O2溶液 | 催化剂MnO2固体、常温 | C或D | |
CO2 | 和 | 常温 | 或 |
N2 | NH4Cl饱和溶液与NaNO2 饱和溶液 | 加热 |
(3)关于装置C和D的下列说法正确的是 。(双项选择)
A.装置C发生反应时,分液漏斗下端必须浸没在液体中。
B.装置D发生反应时,长颈漏斗下端必须浸没在液体中
C.装置C和D的气密性检查的操作方法相同
D.装置C和D均可用于制取一定量的H2