题目内容
 中和反应在日常生活和工农业生产中有广泛的应用.
中和反应在日常生活和工农业生产中有广泛的应用.(1)在烧杯中加入10mL氢氧化钠溶液,滴入几滴酚酞溶液后,再用滴管慢慢滴入稀盐酸至溶液颜色恰好变成无色为止,此时烧杯中溶液的pH是
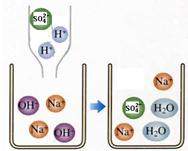
(2)如图是硫酸滴入氢氧化钠溶液中有关粒子之间反应的示意图.由图1中可知:硫酸电离方程式为
(3)为了测定某工厂废水中硫酸的含量,取100g废水于烧杯中,加入160g质量分数为10%的氢氧化钠溶液,恰好完全反应(废水中无不溶物,其它成分不与氢氧化钠反应).请计算:参加反应的硫酸与氢氧化钠的质量比是
分析:氢氧化钠溶液呈碱性,其PH大于7,能使酚酞试液变红,与盐酸恰好完全反应时溶液呈中性,PH为7,不能使酚酞试液变色,根据模拟的微观示意图,可以得出盐酸、氢氧化钠和氯化钠在水溶液中都能电离,根据硫酸与氢氧化钠反应的化学方程式可以确定两者之间的质量关系,进而求算废水中硫酸的质量分数.
解答:解:(1)开始时为氢氧化钠溶液,呈碱性,其OH大于7,滴入稀盐酸至溶液颜色恰好变成无色为止,说明氢氧化钠和盐酸恰好完全反应,溶液呈中性,其PH等于7,故其PH变化为从大于7到等于7,故答案为“等于”
(2)根据模拟的微观示意图,可以得出盐酸、氢氧化钠和氯化钠在水溶液中都能电离,所以本题答案为:硫酸溶液中含有氢离子和硫酸根离子,氢氧化钠溶液含有钠离子和氢氧根离子发生反应实际是硫酸中含有的氢离子和氢氧化钠中含有的氢氧根离子结合成水分子(H++OH-═H2O),所以反应能够进行,故本题答案为:H++OH-═H2O
(3)设废水中含纯硫酸的质量为x
2NaOH+H2SO4 =Na2SO4 +2H2O
80 98
160g×10% x
=
x=19.6g
∴废水中硫酸的质量分数是=
×100%=19.6%
所以本题答案为:49:40,19.6%.
(2)根据模拟的微观示意图,可以得出盐酸、氢氧化钠和氯化钠在水溶液中都能电离,所以本题答案为:硫酸溶液中含有氢离子和硫酸根离子,氢氧化钠溶液含有钠离子和氢氧根离子发生反应实际是硫酸中含有的氢离子和氢氧化钠中含有的氢氧根离子结合成水分子(H++OH-═H2O),所以反应能够进行,故本题答案为:H++OH-═H2O
(3)设废水中含纯硫酸的质量为x
2NaOH+H2SO4 =Na2SO4 +2H2O
80 98
160g×10% x
| 80 |
| 160g×10% |
| 98 |
| x |
x=19.6g
∴废水中硫酸的质量分数是=
| 19.6g |
| 100g |
所以本题答案为:49:40,19.6%.
点评:本题考查了酸碱中和反应时溶液PH的变化以及中和反应的实质和反应时物质之间的质量关系,完成此题,可以依据已有的知识以及图示进行.所以要求同学们在平时的学习中加强课本基础知识的储备,以便能够灵活应用.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目

