题目内容
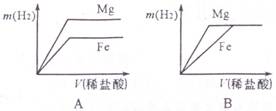
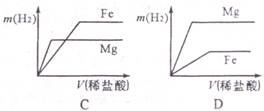
(2011年四川绵阳,17题)相同质量的Mg、Fe分别与稀盐酸作用,产生H2的质量m(H2)与加入稀盐酸的体积V(稀盐酸)关系如下图所示,其中正确的是 ( )


D
本题考查的是金属的化学性质,根据化学反应方程式的计算。相等质量的镁和铁分别与足量的稀盐酸反应,由于稀盐酸过量,因此充分反应后放出氢气的质量大小由金属决定;根据化学方程式Fe+2HCl=FeCl2+H2↑知每56g铁生成2g氢气,根据化学方程式Mg+2HCl=MgCl2+H2↑知每24g镁反应生成2g氢气,所以相等质量的铁和镁与足量稀盐酸反应,镁生成氢气多,对于图象镁的终点纵坐标应该大于铁,可排除选项BC;根据金属活动性强弱关系镁>铁,可判断镁与稀盐酸反应快,铁与稀盐酸反应慢,即稀盐酸与镁的反应时间短、与铁反应消耗时间长。对于图象又可排除选项A。故选D

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目