题目内容
把l4.8g氯酸钾和二氧化锰组成的固体混合物放到大试管中加热,反应完全后,冷却到反应前的温度,称得试管中固体物质的质量为l0.0g.试求:
(1)生成氧气的质量.
(2)原混合物中氯酸钾的质量.
(3)请你分析随着反应的进行,大试管内固体混合物中二氧化锰的质量分数大小变化趋势并解释原因______;反应完全后,固体混合物中二氧化锰的质量分数为______(精确到千分位).
解:(1)根据质量守恒定律可以知道,生成氧气的质量为l4.8g-10.0g=4.8g
(2)设原混合物中氯酸钾的质量为x
2KClO3 2KCl+3O2↑
2KCl+3O2↑
245 96
x 4.8g
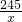 =
=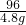
解得:x=12.25g
(3)因为化学反应前后催化剂(二氧化锰)的质量保持不变.而随着反应的进行固体的质量会不断减少,所以大试管内固体混合物中二氧化锰的质量分数逐渐变大;
故二氧化锰的质量=14.8g-12.25g=2.55g.所以大试管内固体混合物中二氧化锰的质量分数为: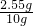 ×100%=25.5%
×100%=25.5%
故答案为:(1)生成氧气的质量为4.8g;
(2)设原混合物中氯酸钾的质量为12.25g;
(3)随着反应的进行,二氧化锰固体的质量不变,而氯酸钾分解产生的氧气逐渐放出,致使大试管内固体质量逐渐减小;25.5%.
分析:(1)在本题中,反应前后固体出现了差值,根据质量守恒定律,减少的质量是氧气的质量;
(2)根据氧气的质量求氯酸钾的质量;
(3)用14.8g减去氯酸钾的质量就等于二氧化锰的质量,根据催化剂在反应中的特点可知反应后二氧化锰的质量分数.
点评:根据质量守恒定律,由反应前后固体物质质量差即反应所产生氧气的质量;利用二氧化锰为反应的催化剂,反应前后质量不变,由混合物质量与参加反应的氯酸钾质量差可求得二氧化锰的质量.
(2)设原混合物中氯酸钾的质量为x
2KClO3
 2KCl+3O2↑
2KCl+3O2↑245 96
x 4.8g
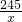 =
=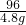
解得:x=12.25g
(3)因为化学反应前后催化剂(二氧化锰)的质量保持不变.而随着反应的进行固体的质量会不断减少,所以大试管内固体混合物中二氧化锰的质量分数逐渐变大;
故二氧化锰的质量=14.8g-12.25g=2.55g.所以大试管内固体混合物中二氧化锰的质量分数为:
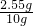 ×100%=25.5%
×100%=25.5%故答案为:(1)生成氧气的质量为4.8g;
(2)设原混合物中氯酸钾的质量为12.25g;
(3)随着反应的进行,二氧化锰固体的质量不变,而氯酸钾分解产生的氧气逐渐放出,致使大试管内固体质量逐渐减小;25.5%.
分析:(1)在本题中,反应前后固体出现了差值,根据质量守恒定律,减少的质量是氧气的质量;
(2)根据氧气的质量求氯酸钾的质量;
(3)用14.8g减去氯酸钾的质量就等于二氧化锰的质量,根据催化剂在反应中的特点可知反应后二氧化锰的质量分数.
点评:根据质量守恒定律,由反应前后固体物质质量差即反应所产生氧气的质量;利用二氧化锰为反应的催化剂,反应前后质量不变,由混合物质量与参加反应的氯酸钾质量差可求得二氧化锰的质量.

练习册系列答案
相关题目