题目内容
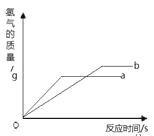
【题目】将等质量的镁、锌、铁放入足量的盐酸中,下列说法正确的是 ( )
A.放出氢气最多的是镁。B.放出氢气最少的是铁。
C.产生氢气速率最快的是镁D.产生氢气速率最慢的是锌
【答案】AC
【解析】
镁、锌、铁三种金属分别与足量稀硫酸反应的化学方程式为:Mg+2HCl=MgCl2+H2↑,Zn+2HCl=ZnCl2+H2↑,Fe+2HCl=FeCl2+H2↑。由化学方程式可知,每生成1克氢与需要这几种物质的质量分别为:Zn:32.5,Fe:28,Mg:12,因为金属质量相同,所以相同质量的金属中镁置换的氢的质量镁最多,铁次之,锌最少。三种金属的活动性为镁>锌>铁,所以产生氢气速率最快的是镁,锌次之,铁最慢。故选AC。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目