题目内容
(6分)守恒思想是以定量的角度观察化学世界的永恒主题。
(1)某化合物在氧气中完全燃烧生成二氧化碳和水,推测该化合物中一定含有的元素
是_______。
(2)向50g溶质质量分数为36%的浓盐酸中加入50g水,所得稀盐酸溶质的质量分数
为_______。
(3)为适应铁路高铁时代提速的要求,需把短轨连成长轨,常用反应:
yAl + Fe2O3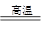 Al2O3 + yFe 进行焊接,该化学方程式中的y值为_______。
Al2O3 + yFe 进行焊接,该化学方程式中的y值为_______。
(4)卫星运载火箭的动力由高氯酸铵(NH4ClO4)发生反应提供,化学方程式为:2NH4ClO4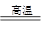 N2↑+Cl2↑+2O2↑+4X。则
N2↑+Cl2↑+2O2↑+4X。则
①X的化学式为_______。
②该反应属于基本反应类型中的________反应。
(5)将56g一氧化碳在34g氧气中充分燃烧,生成二氧化碳的质量为_______。
(1)碳元素和氢元素
(2)18%
(3) 2
(4)① H2O ②分解
(5)88g
【解析】
试题分析:(1)由于反应物氧气中只含氧元素,根据质量守恒定律,在化学反应前后元素的种类没有改变可知,生成物二氧化碳中的碳元素和水中的氢元素一定来自该化合物,即该化合物中一定含有碳、氢两种元素。
(2)根据溶液的溶质质量分数= ×100%,可知50g溶质质量分数为36%的浓盐酸中的溶质为50g×36%=18g,再加入50g水后,溶液质量随之增大,但溶质质量不变,故加水后溶质质量分数=
×100%,可知50g溶质质量分数为36%的浓盐酸中的溶质为50g×36%=18g,再加入50g水后,溶液质量随之增大,但溶质质量不变,故加水后溶质质量分数=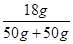 ×100%=18%
×100%=18%
(3)根据质量守恒定律的微观解释进行分析,在化学变化的过程中,原子的种类和个数都不变,即化学方程式左右两边的原子种类和个数应相等,故y=2。
(4)①由反应的化学方程式2NH4ClO4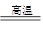 N2↑+Cl2↑+2O2↑+4X可知,
N2↑+Cl2↑+2O2↑+4X可知,
反应前 反应后
氮原子 2 2
氢原子 8 0
氯原子 2 2
氧原子 8 4
根据质量守恒定律,化学变化前后原子的种类、数目不变,可判断生成物的4个X分子中含有8个氢原子和4个氧原子,则每个X的分子是由2个氢原子和1个氧原子构成,物质X的化学式为H2O;
②由于该反应的反应物是一种,生成物是四种,符合分解反应的特征,故该反应属于基本反应类型中的分解反应。
(5)利用一氧化碳在氧气中燃烧的化学方程式,先判断出哪个物质恰好完全反应,再根据质量守恒定律即可求出生成的二氧化碳的质量。
2CO + O2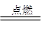 2CO2
2CO2
56 32
56g 32g
由此可判断,一氧化碳完全反应,而氧气有剩余,且剩余34g-32g=2g;
根据质量守恒定律可知,参加反应的物质质量之和等于生成的物质的质量之和,故生成的二氧化碳的质量=56g+32g=88g。
考点:质量守恒定律及其应用,有关溶质质量分数的简单计算,根据化学反应方程式的计算
点评:理解和熟练掌握质量守恒定律及其应用是解题的关键,熟记质量守恒定律中的六个不变:(宏观)1、反应前后物质总质量不变,2、元素的种类不变,3、元素的总质量不变;(微观)4、原子的种类不变,5、原子的数目不变,6、原子的质量不变。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案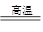 Al2O3 + yFe 进行焊接,该化学方程式中的y值为_______。
Al2O3 + yFe 进行焊接,该化学方程式中的y值为_______。 Al2O3+yFe 进行焊接,该化学方程式中的y值为______.
Al2O3+yFe 进行焊接,该化学方程式中的y值为______.