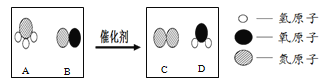
题目内容
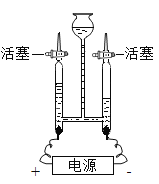
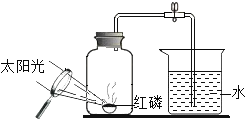
【题目】某同学设计了测定空气中氧气含量的实验,实验装置如图。请回答下列问题:
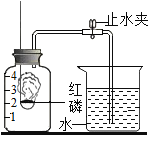
(1)该实验中红磷需稍过量,目的是_______________。
(2)集气瓶中的现象是_____________,其反应的文字表达式为________________;打开止水夹后观察到的现象是______________,由此可得出的结论为________________。
(3)该实验可推论出氮气_________(填“易”或“难”)溶于水和其化学性质________(填“活泼”或“不活泼”)的结论。
(4)若将红磷换成硫磺,该实验能否获得成功_________?为什么?_________________。
【答案】将集气瓶中的氧气反应完全 产生大量白烟 磷+氧气![]() 五氧化二磷 烧杯中的水进入集气瓶,液面开始上升,升至刻度线“1”处停止 空气中氧气体积约占1/5 难 不活泼 不能 硫磺在氧气中燃烧产生二氧化硫气体,瓶内压强变化不明显
五氧化二磷 烧杯中的水进入集气瓶,液面开始上升,升至刻度线“1”处停止 空气中氧气体积约占1/5 难 不活泼 不能 硫磺在氧气中燃烧产生二氧化硫气体,瓶内压强变化不明显
【解析】
(1)使用过量的红磷可以将装置内的氧气反应完全,实验结果更准确;
(2)红磷在氧气中剧烈燃烧,产生大量白烟,放出大量的热;红磷燃烧反应原理:磷+氧气![]() 五氧化二磷;待冷却后,打开水止水夹烧杯中的水进入集气瓶,液面开始上升,升至刻度线“1”处停止;说明氧气占空气体积的1/5;
五氧化二磷;待冷却后,打开水止水夹烧杯中的水进入集气瓶,液面开始上升,升至刻度线“1”处停止;说明氧气占空气体积的1/5;
(3)红磷燃烧时,氮气未参加反应,说明氮气的化学性质不活泼,当烧杯中的水进入集气瓶内,液面停至刻度线“1”处,说明氮气难溶于水;
(4)将红磷换成硫磺,硫磺在氧气中燃烧产生二氧化硫气体,瓶内压强变化不明显,不能测量空气中氧气含量。

 王后雄学案教材完全解读系列答案
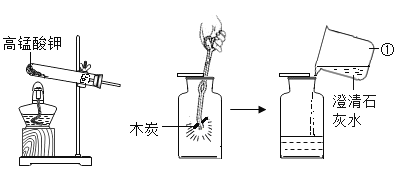
王后雄学案教材完全解读系列答案【题目】学习了二氧化锰对过氧化氢有催化作用的知识后。某同学想:氧化铜能否起到类似二氧化锰的催化剂作用昵?于是进行了如下探究。
(提出猜想)
I.氧化铜不是催化剂、也不参与反应,反应前后质量和化学性质不变;
II.氧化铜参与反应产生氧气,反应前后质量和化学性质发生了改变;
III.氧化铜是反应的催化剂,反应前后质量和化学性质不变。
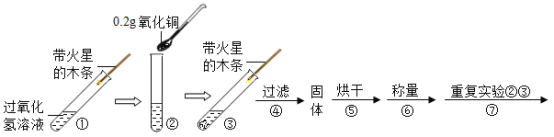
(进行实验)用天平称量 0.2g化氧铜,取5mL5%过的氧化氢溶液于试管中,进行如下实验:
(1)填写下表:
步骤③ 现象 | 步骤⑥ 结果 | 步骤⑦ 现象 | 结论 |
________________, 带火星的木条复燃 | 所得固体 _______________g | 溶液中有气泡放出, 带火星的木条复燃 | 猜想I、Ⅱ 不成立 猜想Ⅲ 成立 |
(2)步骤①的目的.是与步骤_______对比,检验加入氧化铜前后双氧水分解速度有无变化。
(3)过氧化氢能被氧化铜催化分解放出氧气的化学反应的文字表达式为___________ 。