题目内容
通过学习我们知道,在化学变化中物质发生了改变,但质量是否改变了呢?为此某校甲、乙两个兴趣小组对这个问题进行了探究,过程如下:[提出问题]:参加反应的反应物总质量与生成物总质量是否相等
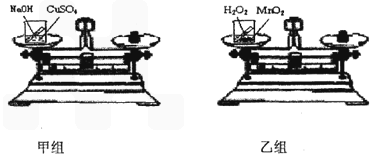
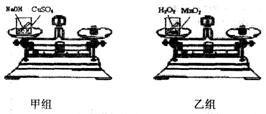
[实验方案]:甲、乙两个兴趣小组分别设计了如图所示的实验
[进行实验]:如图所示,甲小组把盛有适量NaOH溶液的小试管放入盛有CuSO4溶液盼烧杯中,乙小组把盛有适量H2O2溶液的小试管放入盛有MnO2的烧杯中;然后将烧杯放到天平上调至平衡;接着取下烧杯并将其倾斜,使物质混合发生反应,待反应后再把烧杯放到天平上,观察天平是否平衡.
[实验现象]:反应后,甲小组的天平指针指向刻度盘的______(填“左边”、“右边”或“中间”),乙小组的天平指针指向刻度盘的右边.
[解释与结论]:甲小组的结论为:______,
化学方程式为CuSO4+2NaOH═Cu(OH)2↓+Na2SO4.乙小组的指针偏向右边是因为______.
[反思与与评]:比较两个小组的实验设计,你得到的启发是______.

【答案】分析:只要是化学变化,都遵循质量守恒定律,质量减少一定是有气体生成跑出(或在气球中产生浮力),只要是质量增加,一定有别的物质参加了反应,没有气体跑出的反应(产生的浮力忽略不计)中天平处于平衡状态.
解答:解;甲小组把盛有适量NaOH溶液的小试管放入盛有CuSO4溶液烧杯中,氢氧化钠与硫酸铜反应生成硫酸钠和氢氧化铜,没有气体跑出,所以指针指向中间,获得的结论是参加反应的CuSO4和NaOH总质量与生成物Cu(OH)2和Na2SO4的总质量相等;乙小组把盛有适量H2O2溶液的小试管放入盛有MnO2的烧杯中,过氧化氢溶液与二氧化锰混合后生成了水和氧气,氧气逸散到空气中,质量变轻,天平偏向右边;得到的启发是验证质量守恒定律应当在密闭体系中进行.
故答案为:①中间
②参加反应的CuSO4和NaOH总质量与生成物Cu(OH)2和Na2SO4的总质量相等
③生成的氧气(O2)是气态,没有称量
④验证质量守恒定律应当在密闭体系中进行.
点评:在设计验证质量守恒的实验时要考虑实验在密闭容器中进行,组装装置时注意实验的准确性和安全性.
解答:解;甲小组把盛有适量NaOH溶液的小试管放入盛有CuSO4溶液烧杯中,氢氧化钠与硫酸铜反应生成硫酸钠和氢氧化铜,没有气体跑出,所以指针指向中间,获得的结论是参加反应的CuSO4和NaOH总质量与生成物Cu(OH)2和Na2SO4的总质量相等;乙小组把盛有适量H2O2溶液的小试管放入盛有MnO2的烧杯中,过氧化氢溶液与二氧化锰混合后生成了水和氧气,氧气逸散到空气中,质量变轻,天平偏向右边;得到的启发是验证质量守恒定律应当在密闭体系中进行.
故答案为:①中间
②参加反应的CuSO4和NaOH总质量与生成物Cu(OH)2和Na2SO4的总质量相等
③生成的氧气(O2)是气态,没有称量
④验证质量守恒定律应当在密闭体系中进行.
点评:在设计验证质量守恒的实验时要考虑实验在密闭容器中进行,组装装置时注意实验的准确性和安全性.

练习册系列答案
相关题目
 33、通过学习我们知道,在化学变化中物质发生了改变,但质量是否改变了呢?为此某校甲、乙两个兴趣小组对这个问题进行了探究,过程如下:
33、通过学习我们知道,在化学变化中物质发生了改变,但质量是否改变了呢?为此某校甲、乙两个兴趣小组对这个问题进行了探究,过程如下: