题目内容
【题目】科学家设想利用太阳能加热器“捕捉CO2”、“释放CO2”,实现碳循环。
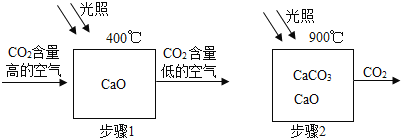
(1)步骤1的化学方程式为 。
(2)为确定步骤2中的碳酸钙是否完全分解,设计的实验步骤为:取少量固体于试管中,滴加过量
溶液,若观察到试管内 ,则分解不完全。
(3)上述设想的优点有 (填字母序号)。
a.原料易得且可循环利用
b.充分利用太阳能
c.可全地域全天候使用
(4)CO2是宝贵的碳氧资源.CO2和H2在一定条件下可合成甲酸(HCOOH),此反应中CO2与H2的分子个数比为 ,若要检验1%甲酸水溶液是否显酸性,能选用的有 (填字母序号)。
a.无色酚酞溶液
b.紫色石蕊溶液
c.pH试纸
(5)请列举CO2的另两种用途 , 。
【答案】(1)CaO+CO2CaCO3;
(2)盐酸;有气泡产生;
(3)ab;
(4)1:1;bc;
(5)灭火;制碳酸饮料
【解析】
试题分析:(1)根据图示信息可知二氧化碳和氧化钙在400℃生成碳酸钙,方程式是:CaO+CO2CaCO3;
(2)因为碳酸钙遇酸产生二氧化碳,所以取少量固体于试管中,滴加过量盐酸,若观察到试管内有气泡产生,则含有未分解的碳酸钙;
(3)观察流程图可以看出反应原料是氧化钙和二氧化碳,反应条件是利用太阳能,因此有原料易得且可循环利用,充分利用太阳能的优点,但会受到地域、天气的限制的缺点,故可全地域全天候使用是错误的;
(4)一分子的CO2和一分子的H2在一定条件下可合成一分子的甲酸(HCOOH),因此此反应中CO2与H2的分子个数比为1:1;酸性物质能够使紫色的石蕊试液变成红色,不能使酚酞试液变色,用pH试纸测定的pH会<7,因此选择bc;
(5)因为二氧化碳不能燃烧,也不能支持燃烧,密度比空气大,故可以用来灭火;二氧化碳溶于水产生碳酸,可以制碳酸饮料等,另外还可以做制冷剂、人工降雨等。

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案【题目】下列各项研究中属于化学科学研究的内容的是( )
A.设计更优越的办公系统,开发人工智能
B.开发研究新能源,研制新型化学合成材料
C.培育杂交水稻,提高农作物产量
D.研制赛车的动力系统,提高赛车速度
【题目】【2014年贵州省黔东南州市】学习了CO2的有关知识后,同学们查阅资料发现Mg能在CO2中燃烧:2Mg+CO2═2MgO+C,所以镁着火不能来CO2来灭火,但没有找到有关Na能否与CO2反应的介绍.于是同学们展开了钠着火能否用CO2来灭火的探究.
【提出猜想】钠能发生类似于CO2与镁的反应,可能的化学方程式为 _________ .
【实验】将燃着的钠伸入装有CO2的集气瓶中,钠能在集气瓶中继续燃烧.
进一步【查阅资料】得知:
①Na2O是白色固体,能与CO2反应生成Na2CO3,也能与H2O反应生成NaOH.
②Ba(OH)2溶于而BaCO3不溶于水.
③Na2CO3的存在会干扰NaOH的检测.
基于以上资料,同学们认为钠在CO2中燃烧的产物情况有所不同,并对产物提出了以下几种猜想:
Ⅰ.Na2O、C;Ⅱ _________ 、C;Ⅲ.NaOH、C;Ⅳ.Na2O、Na2CO3、C
通过理论分析,猜想 _________ (填序号)肯定错误的,理由是 _________
【验证猜想】
步骤 | 实验操作 | 主要实验现象 | 结论(燃烧产物判断) |
(1) | 将产物溶于适量水中 | 部分溶解,试管底部有黑色固体 | 燃烧产物中肯定有C |
(2) | 取少量(1)所得上层溶液,加入过量的BaCl2溶液 | _________ | 燃烧产物中肯定有Na2CO3 |
(3) | 取少量(2)所得上层清液,加入 _________ 溶液 | 有蓝色沉淀生成 | 燃烧产物中肯定有 _________ |
在步骤(2)中BaCl2溶液为什么要加入至过量?其原因是: _________ .
【结论】猜想 _________ (填序号)是正确的.