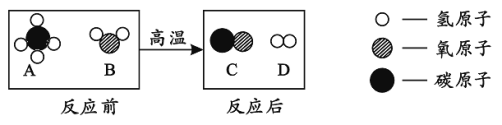
题目内容
【题目】水是生命之源,“珍惜水、节约水、保护水”是每个公民的义务和责任。
(1)下列“水”属于纯净物的是_____(填字母)
A蒸馏水 B矿泉水 C自来水 D地下水
(2)无论是自来水还是纯净水,保持水的化学性质的最小粒子是_____(填文字)
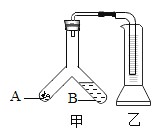
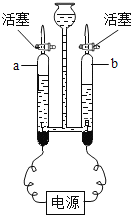
(3)用如图装置进行电解水的实验,b中收集到的气体是_____,该实验说明水是由_____组成的。
(4)生活中常用_____检验地下水是硬水还是软水。
(5)自来水中含有少量Ca(HCO3)2等可溶性化合物,烧水时Ca(HCO3)2发生分解反应,生成难溶性的碳酸钙、水和二氧化碳,这就是壶中出现水垢的原因之一。请写出固体Ca(HCO3)2受热分解的化学方程式_____。
(6)高铁酸钾(K2FeO4)是一种新型、高效的多功能水处理剂。高铁酸钾受热时发生的反应为4K2FeO4![]() 2R+4K2O+3O2↑,则R是_____(填化学式)。
2R+4K2O+3O2↑,则R是_____(填化学式)。
【答案】A 水分子 氢气 氢元素和氧元素 肥皂水 Ca(HCO3)2![]() CaCO3↓+CO2↑+H2O Fe2O3
CaCO3↓+CO2↑+H2O Fe2O3
【解析】
(1)混合物是由两种或两种以上的物质组成,矿泉水、自来水、地下水都属于混合物;纯净物是由一种物质组成,蒸馏水中只有水分子,属于纯净物中的氧化物,故选A;
(2)由分子构成的物质分子是保持物质化学性质的最小微粒,水是由水分子构成,故保持水化学性质的最小微粒是水分子;
(3)水电解时,正极产生氧气,负极产生氢气,体积比为1:2 。如图装置进行电解水的实验,根据氧气与氢气体积的多少,因此b中收集到的较多的气体是氢气;氢气是由氢元素组成,氧气是由氧元素组成,在化学反应中元素的种类不变,该实验说明水是由氢元素和氧元素组成的;
(4)向水中加入肥皂水时,如果产生的泡沫较多,是软水,如果产生大量浮渣,是硬水。生活中常用肥皂水检验地下水是硬水还是软水;
(5)Ca(HCO3)2受热分解生成碳酸钙、水和二氧化碳,反应的化学方程式为:Ca(HCO3)2![]() CaCO3↓+CO2↑+H2O;
CaCO3↓+CO2↑+H2O;
(6)在化学方程式4K2FeO4![]() 2R+4K2O+3O2↑中,反应物中钾、铁、氧原子个数分别为8、4、16,反应后的生成物中钾、铁、氧原子个数分别为8、0、10,根据反应前后原子种类、数目不变,则2R中含有4个铁原子和6个氧原子,则每个R分子由2个铁原子和3个氧原子构成,物质R的化学式为Fe2O3。
2R+4K2O+3O2↑中,反应物中钾、铁、氧原子个数分别为8、4、16,反应后的生成物中钾、铁、氧原子个数分别为8、0、10,根据反应前后原子种类、数目不变,则2R中含有4个铁原子和6个氧原子,则每个R分子由2个铁原子和3个氧原子构成,物质R的化学式为Fe2O3。

 阅读快车系列答案
阅读快车系列答案【题目】除去下列物质中混有的少量杂质所选用的试剂,不正确的是( )
选项 | 混合物(括号内为杂质) | 选用的试剂 |
A |
| 足量饱和的氢氧化钠溶液 |
B |
| 足量的氧化铜粉末 |
C |
| 灼热的氧气 |
D |
| 足量饱和的氢氧化纳溶液 |
A.AB.BC.CD.D