题目内容
(2011?宝坻区一模)质量相同的镁、铁、锌三块金属,______所含的原子最多,它们分别与足量的稀盐酸完全反应时,生成氢气由少到多的顺序是______.
【答案】分析:同质量的金属,原子数最多即原子质量最小,因为原子的原子量与其质量是成正比关系;
根据选项中元素的相对原子质量和它们与稀盐酸反应的化学方程式,计算出1g这些金属分别与足量稀盐酸反应生成氢气的质量,再进行比较即可.
解答:解:元素的原子量与其真实质量成正比,由于原子量的大小关系是镁<铁<锌,所以真实质量也是这一关系,故相同质量的三种金属含原子的多少关系是:镁>铁>锌.
故答案为:镁
Mg的相对原子质量为24,24g镁可反应生成2g氢气,即1g镁生成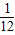 克氢气.
克氢气.
Zn的相对原子质量为65,65g锌可反应生成2g氢气,即1g锌生成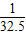 克氢气.
克氢气.
铁的相对原子质量56,56g铁可反应生成2g氢气,即1g铁生成 g氢气.
g氢气.
故生成氢气由少到多的顺序是锌<铁<镁
故答案为:锌<铁<镁
点评:本题主要考查考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.
根据选项中元素的相对原子质量和它们与稀盐酸反应的化学方程式,计算出1g这些金属分别与足量稀盐酸反应生成氢气的质量,再进行比较即可.
解答:解:元素的原子量与其真实质量成正比,由于原子量的大小关系是镁<铁<锌,所以真实质量也是这一关系,故相同质量的三种金属含原子的多少关系是:镁>铁>锌.
故答案为:镁
Mg的相对原子质量为24,24g镁可反应生成2g氢气,即1g镁生成
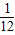 克氢气.
克氢气.Zn的相对原子质量为65,65g锌可反应生成2g氢气,即1g锌生成
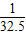 克氢气.
克氢气.铁的相对原子质量56,56g铁可反应生成2g氢气,即1g铁生成
 g氢气.
g氢气.故生成氢气由少到多的顺序是锌<铁<镁
故答案为:锌<铁<镁
点评:本题主要考查考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
 (2011?宝坻区一模)运用下图的溶解度表与溶解度曲线回答下列问题:
(2011?宝坻区一模)运用下图的溶解度表与溶解度曲线回答下列问题:| 温度/℃ | 10 | 30 | 50 | 60 | |
| 溶解度/g | 氯化钠 | 35.8 | 36.3 | 37.0 | 37.3 |
| 硝酸钾 | 20.9 | 45.8 | 85.5 | 110 | |
(2)60℃时,100g水中加入100g硝酸钾,所得溶液是______(填“饱和”或“不饱和”)溶液,此时,所得硝酸钾溶液的溶质质量分数为______;当60℃的该溶液降温到30℃时,析出晶体的质量为______g.
(3)当A的溶液从t1℃升高t2℃时,溶液中溶质的质量分数将______(选填“变大”或“变小”或“不变”).
(2011?宝坻区一模)铬(Cr)为不锈钢主要的添加元素.铁中加入铬,当铬的含量达12%以上时,就成为不锈钢,在氧化环境中它的表面可以生成钝化膜,有很高的耐腐蚀性.请回答下列问题:
(1)铁生锈的主要原因是铁与______直接接触.
(2)不锈钢是______(填“纯净物”或“混合物”).
(3)相同温度下,取大小相同、表面光亮的Cr、Mg、Cu三种金属薄片,分别投入足量相同浓度的稀盐酸中,现象如下:
①从上述探究实验得知,上述三种金属的活动性由强到弱的顺序是______.
②请你判断:Cr______(填“能”或“不能”)跟氯化银反应.
(1)铁生锈的主要原因是铁与______直接接触.
(2)不锈钢是______(填“纯净物”或“混合物”).
(3)相同温度下,取大小相同、表面光亮的Cr、Mg、Cu三种金属薄片,分别投入足量相同浓度的稀盐酸中,现象如下:
| 金属 | Cr | Mg | Cu |
| 与盐酸反应现象 | 放出气泡速率缓慢 | 放出气泡速率较快 | 无明显现象 |
②请你判断:Cr______(填“能”或“不能”)跟氯化银反应.


