题目内容
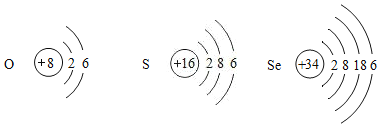
【题目】我国约在南北朝时就开始冶炼黄铜,黄铜是铜和锌的合金(Cu﹣Zn),它可用来制造电器零件及日用品。为了测定某黄铜样品中铜的质量分数,取10g该样品向其中加入一定量的稀硫酸,恰好完全反应,产生氢气的质量与加入稀硫酸的质量关系如图所示。请解答下列问题:
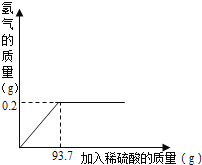
(1)完全反应后,生成H2的质量为_____。
(2)该黄铜样品中铜的质量分数为______?(写出计算过程)
【答案】(1)0.2g (2)35%
【解析】
试题(1)铜属于H后不活泼金属,不能与稀酸反应,锌属于H前活泼金属,能与稀酸反应产生氢气;故铜和锌的合金中加入一定量的稀硫酸后,锌与稀硫酸反应生成硫酸锌和氢气;根据质量关系图可知,当加入93.7g稀硫酸时,恰好完全反应,且放出气体氢气的质量为0.2g。
(2)根据题意书写反应的化学方程式Zn+H2SO4=ZnSO4+H2↑,利用化学方程式中锌与氢气的质量比,根据氢气的质量求出锌的质量,从而求出合金中铜的质量,最后可求出合金中铜的质量分数。
解:设该合金中锌的质量为 x
Zn + H2SO4 = ZnSO4+ H2↑
65 2
x 0.2g
![]()
解得x=6.5g
则该合金中铜的质量分数为 ×100% =35%
答:该合金中铜的质量分数为35%。

 提分百分百检测卷单元期末测试卷系列答案
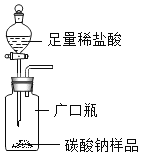
提分百分百检测卷单元期末测试卷系列答案【题目】某研究小组利用注射器将空气压入装有澄清石灰水的锥形瓶中(如图),以检验空气中二氧化碳的存在,实验过程中,有的同学三四分钟就观察到澄清石灰水变浑浊,有的同学过了十分钟才观察到变浑浊的现象,而有的同学则没有观察到变浑浊的现象。
(提出问题)澄清石灰水变浑浊时间的长短与什么因素有关?
(提出猜想)①与澄清石灰水的浓度有关。
②与澄清石灰水的量有关。
(进行实验)
实验一:配制饱和澄清石灰水,用饱和澄清石灰水兑水配制不同浓度的澄清石灰水。
[提示]饱和澄清石灰水是指在一定温度下浓度最大的澄清石灰水。
实验序号 | 1 | 2 | 3 | 4 |
饱和澄清石灰水(蒸馏水) /mL | 2(0) | 1.5(0.5) | 1(1) | 0.5(1.5) |
缓慢通入3L空气的浑浊度 | 明显 | 较明显 | 不明显 | 无现象 |
实验二:
实验序号 | 1 | 2 | 3 | 4 |
饱和澄清石灰水体积/mL | 1 | 1.5 | 2 | 2.5 |
缓慢通入2L空气的浑浊度 | 非常明显 | 明显 | 不明显 | 非常不明显 |
(1)空气中二氧化碳的体积分数是_____。
(2)澄清石灰水变浑浊的化学方程式是_____。
(3)实验一中澄清石灰水浓度最大的是_____(填序号)。
(4)实验一的目的是_____。
(5)从实验二可以得出的结论是_____。
(6)针对实验一和实验二,你对“空气中二氧化碳检验”的实验中澄清石灰水的用量和浓度有什么建议?
答:_____。