题目内容
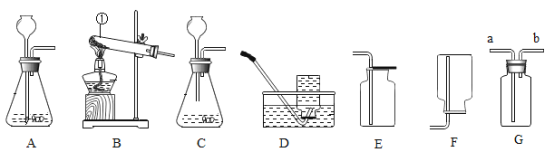
【题目】实验室开放日,某化学兴趣小组的同学在老师的指导下,设计了如下实验装置进行实验和探究,请回答有关问题。
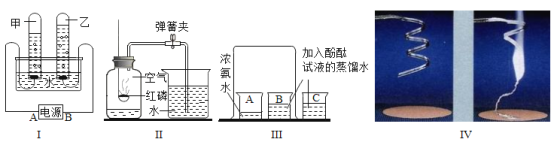
(1)实验I中:甲、乙两试管中产生的气体在相同条件下体积比为__________,其中乙试管中的气体有__________性,因此可用于焊接金属时使用。电解水的化学方程式为____________。
(2)实验Ⅱ中,实验前在集气瓶内加少量水,将集气瓶上方空气分成五等份,并做好记号,红磷熄灭并冷却至室温后,打开弹簧夹,此时可观察到的现象为_____________。如果未等到装置冷却到室温就打开弹簧夹,测得的结果会______(填“偏大”或“偏小”或“无影响”)
(3)实验Ⅲ中观察到的现象是__________,请你用分子的知识解释出现该现象的原因___________;
(4)如图Ⅳ所示,将镁条在空气中点燃。称量燃烧前(镁条)、后(石棉网上灰烬)的质量,发现不相等。
①小明认为镁条燃烧后“石棉网上灰烬的质量”应较反应前“镁条的质量”增加,而小康则认为质量应减少。试陈述两位同学的理由:_________
②若使上述镁条燃烧符合质量守恒定律,应如何改进_________?
【答案】2:1 助燃 2H2O![]() 2H2↑+O2↑ 烧杯中的水进入集气瓶内,约占集气瓶内空气体积的五分之一 偏小 B烧杯中的溶液颜色变成红色,A、C烧杯中没有观察到明显的现象 A烧杯中的氨分子运动到B烧杯中,使酚酞试液变红 小明的理由是镁条燃烧消耗了氧气,生成的氧化镁的质量大于反应的镁条的质量;小康的理由是镁条燃烧生成的白烟逸散到空气中去了,质量应减少 将实验在密闭容器内进行
2H2↑+O2↑ 烧杯中的水进入集气瓶内,约占集气瓶内空气体积的五分之一 偏小 B烧杯中的溶液颜色变成红色,A、C烧杯中没有观察到明显的现象 A烧杯中的氨分子运动到B烧杯中,使酚酞试液变红 小明的理由是镁条燃烧消耗了氧气,生成的氧化镁的质量大于反应的镁条的质量;小康的理由是镁条燃烧生成的白烟逸散到空气中去了,质量应减少 将实验在密闭容器内进行
【解析】
(1)甲试管内生成的气体体积较多,是氢气,乙试管中产生的气体体积较少,是氧气,在相同条件下体积比为2:1;其中乙试管中的氧气有助燃性,因此可用于焊接金属时使用;电解水生成氢气和氧气,反应的化学方程式2H2O![]() 2H2↑+O2↑:故填:2:1;助燃;2H2O
2H2↑+O2↑:故填:2:1;助燃;2H2O![]() 2H2↑+O2↑。
2H2↑+O2↑。
(2)红磷燃烧来测定空气中氧气的含量,发生的实验现象是:红磷燃烧,产生大量白烟,灭后没有完全冷却到室温就打开弹簧夹,实验结果会偏低,其原因是:与室温相比,剩余气体温度较高,压强偏大,因此进入集气瓶中的水偏少.故填:烧杯中的水进入集气瓶内,约占集气瓶内空气体积的五分之一;偏小。
(3)实验Ⅲ中可以观察到B烧杯中的溶液颜色变成红色,A、C烧杯中没有观察到明显的现象。出现该现象的原因是:A烧杯中的氨分子运动到B烧杯中,使酚酞试液变红;故填:B烧杯中的溶液颜色变成红色,A、C烧杯中没有观察到明显的现象;A烧杯中的氨分子运动到B烧杯中,使酚酞试液变红。
(4)①小明的理由是镁条燃烧消耗了氧气,生成的氧化镁的质量大于反应的镁条的质量;小康的理由是镁条燃烧生成的白烟逸散到空气中去了,质量应减少;
②验证质量守恒定律的实验时选用药品和装置应该考虑到如果反应物中有气体参加反应,或生成物中有气体生成,应该选用密闭装置,因此将实验在密闭容器内进行即可.
故填:①小明的理由是镁条燃烧消耗了氧气,生成的氧化镁的质量大于反应的镁条的质量;小康的理由是镁条燃烧生成的白烟逸散到空气中去了,质量应减少;②将实验在密闭容器内进行。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案