题目内容
【题目】食盐(主要成分是氯化钠)是维持人体正常生理活动必不可少的物质。
(1)氯化钠由_____构成(填粒子符号)。氯化钠中钠元素的质量分数为_____(结果保留一位小数)
(2)硫酸镁可以改变钠盐的“口味”,硫酸镁的化学式为_____,各元素质量比为_____。
(3)碘盐能补充人体所需碘_____(填“原子”、“分子”、“元素”或“单质”),碘盐中加了碘酸钾(KIO3),其中碘元素的化合价为_____。
【答案】Na+和Cl﹣; 39.3%; MgSO4; 3:4:8; 元素; +5。
【解析】
(1)氯化钠是含有金属元素和非金属元素的化合物,氯化钠是由钠离子和氯离子构成的,其离子符号是Na+和Cl﹣。
氯化钠中钠元素的质量分数为![]() ×100%≈39.3%。
×100%≈39.3%。
(2)硫酸镁中镁元素显+2价,硫酸根显﹣2价,其化学式为MgSO4;硫酸镁中镁、硫、氧元素的质量比为24:32:(16×4)=3:4:8。
(3)碘盐能补充人体所需碘,这里的“碘”不是以单质、分子、原子等形式存在,这里所指的“碘”是强调存在的元素,与具体形态无关。
钾元素显+1价,氧元素显﹣2价,设碘元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)+x+(﹣2)×3=0,则x=+5价。

 开心练习课课练与单元检测系列答案
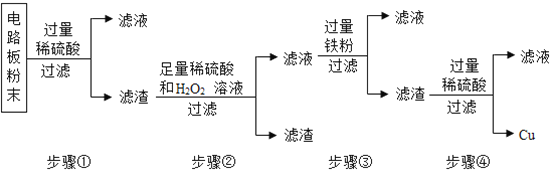
开心练习课课练与单元检测系列答案【题目】小明参观某养鱼池时,好奇地发现农民向养鱼池中撒一种叫做过氧化钙的淡黄色固体,用来增加鱼池中的含氧量。小明刚学完氧气的实验室制法,于是他想可否用过氧化钙来制取氧气。
[提出问题]过氧化钙可否用于制取氧气?
[查阅资料]过氧化钙(CaO2)室温下稳定,在300℃时分解成氧气,可做增氧剂、杀菌剂等。
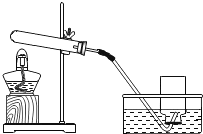
[猜想与论证](1)小明依据_____,提出猜想Ⅰ。
猜想Ⅰ:用加热过氧化钙可制取氧气。
验证猜想Ⅰ是否正确的有关实验如下表,完成表中的空白处:
实验装置 | 实验主要过程 |
| ①检验装置气密性。操作如下:将导管伸入液面下,用手紧握试管,观察到_____,松开后,有液体进入导管; ②加入过氧化钙,加热,导管口有大量气泡冒出; ③收集一瓶气体,图示收集方法为_____,能用该方法收集氧气的原因是_____; ④停止加热。熄灭酒精灯前,应_____; ⑤检验气体。方法是_____。 |
实验结论:通过上述实验证明,加热过氧化钙可制取氧气 | |
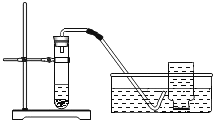
(2)小明联想到农民用过氧化钙增加鱼池中的含氧量,提出猜想Ⅱ。
猜想Ⅱ:过氧化钙与水反应可制取氧气。
验证猜想Ⅱ是否正确的有关实验如下面表格。
实验装置 | 实验主要过程 |
| ①检装置气密性 ②加入过氧化钙和水后,有少量细小气泡缓慢放出,在导管口几乎看不到气体。该装置放置到第二天,集气瓶中只收集到极少量气体,震荡试管后仍有少量细小气泡缓慢放出 |
实验结论:通过上述实验证明,不能用过氧化钙与水反应制取氧气 | |
[分析与反思]:
①虽然没有快速收集到大量氧气,但由此实验现象,小明认为农民用过氧化钙做增氧剂的主要原因是_____。
②小明希望对此实验进行改进,使该反应加快,你能帮他提出建议吗?你的合理建议是:_____。(建议是否可行,还需进一步通过实验验证)。
[质疑再探究]:纯氧能使带火星的木条复燃,若氧气不纯能不能使带火星的木条复燃呢?使带火星的本条复燃的氧气的最低浓度又是多少呢?带着这些问题小明查阅资料。
实验编号 | ① | ② | ③ | ④ |
氧气的体积分数 | 20% | 30% | 40% | 50% |
带火星木条的状况 | 无变化 | 微亮 | 复燃 | 复燃 |
①小明认为实验_____没有必要做,理由是_____。
②自上表可知,当氧气的体积分数达到_____时,即可使带火星的木复燃。
③采用“半值法”探究能减少实验次数,若你还想更精准地测定能使带火星的木条复燃的氧气体积分数,你选择氧气体积分数为_____来实验。假设排水法能收集到纯净的氧气,若用一个300mL的集气瓶来做此实验,需要计算出集气瓶中预先注入水的体积(设为x),请你列出天于x的方程:_____。
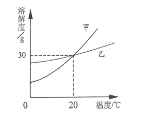
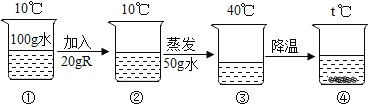
【题目】如表中数据为氯化钠和硝酸钾在不同温度时的溶解度,如图所示是用其中一种物质所做的实验。下列分析正确的是( )
温度(℃) | 10 | 20 | 30 | 40 | |
溶解度/g | KNO3 | 20.9 | 31.6 | 45.8 | 63.9 |
NaCl | 35.8 | 36.0 | 36.3 | 36.6 | |
A. 实验中加入的物质R是氯化钠
B. ③中的溶液可能是饱和溶液
C. ④中t的取值范围在30~40之间
D. ④中溶液的溶质质量分数可能比②中的大