题目内容
 人类的生活离不开金属材料
人类的生活离不开金属材料(1)金属材料应用广泛,试回答下列生活中的问题:
①多数合金的熔点
低于
低于
(填“高于”或“低于”)组成它的成分金属.②家用热水瓶内胆壁的银白色金属是
Ag
Ag
(填化学式),它在自然界中主要以单质
单质
(填“单质”、“化合物”)形式存在.③制造奥运火炬的铝合金材料具有较好的抗腐蚀性,这是因为常温下铝和空气中的氧气反应生成一层
致密的氧化膜
致密的氧化膜
;火炬中的燃料(C3H8)在空气中完全燃烧的化学方程式为C3H8+5O2
3CO2+4H2O
| ||
C3H8+5O2
3CO2+4H2O
;火炬传递结束,采用关闭燃气阀门的方法熄灭火炬,其中蕴含的灭火原理是
| ||
隔离可燃物
隔离可燃物
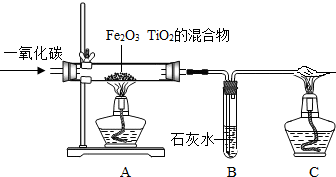
.(2)科学家发现月球的沙土中含有丰富的含氧钛铁矿,成分为TiO2、Fe2O3的混合物.现利用CO来还原TiO2、Fe2O3的混合物提炼单质钛和铁,装置如图所示,试回答:
①写出硬质玻璃管中CO和TiO2反应的化学方程式:
2CO+TiO2
Ti+2CO2
| ||
2CO+TiO2
Ti+2CO2
| ||
②用CO还原钛铁矿,得到钛和铁的混合物,请用简单的物理方法将两种物质分开
用磁铁吸引
用磁铁吸引
.③开始实验时,A装置中首先要进行的操作是
通CO
通CO
(填“加热”或“通CO”),这样做的理由是排净装置内空气防止爆炸
排净装置内空气防止爆炸
;C装置中点燃酒精灯的作用是
将一氧化碳点燃转化为二氧化碳,防止污染环境
将一氧化碳点燃转化为二氧化碳,防止污染环境
.④(5分)若TiO2、Fe2O3的混合物的质量为10克,充分反应后,②中分离出的铁的质量为5.6克,试计算:含氧钛铁矿中Fe2O3的质量分数.(写出计算过程)
分析:(1)①根据合金与组成成分金属的性质不同考虑;②根据银具有化学性质稳定考虑;③根据氧化铝的特点、方程式的书写方法,灭火方法考虑;
(2)①根据方程式的写法考虑;②根据磁铁具有吸引铁的作用考虑;③根据一氧化碳还原金属氧化物实验的注意事项考虑.④根据铁的质量计算出氧化铁的质量,再除以10g即可
(2)①根据方程式的写法考虑;②根据磁铁具有吸引铁的作用考虑;③根据一氧化碳还原金属氧化物实验的注意事项考虑.④根据铁的质量计算出氧化铁的质量,再除以10g即可
解答:解:(1)①合金要比它的组成成分金属的熔点低、硬度大、耐腐蚀性强;
②银具有辐射热量的作用,在家用热水瓶内胆壁具有保温作用,由于银的化学性质稳定,主要以单质的形式存在;
③铝与氧气反应生成氧化铝是一层致密的氧化膜,对内部起到保护作用;C3H8在空气中完全燃烧的反应物是C3H8和氧气,生成物是二氧化碳和水,先配平碳和氢,最后配平氧,反应条件是点燃,写在等号的上边;所以方程式是:C3H8+5O2
3CO2+4H2O;关闭燃气阀门的方法熄灭火炬,是将可燃物隔离了,没有了可燃物就不能燃烧了;
(2)①CO和TiO2反应的反应物是CO和TiO2生成物是Ti和CO2,用观察法配平,所以方程式是:2CO+TiO2
Ti+2CO2;
②因为磁铁能够吸引铁,而不能吸引其它金属,所以用磁铁吸引就行;
③实验前必须先通入一氧化碳,排净装置内空气,防止爆炸,由于一氧化碳有毒,排放到空气中污染空气,所以用酒精灯点燃,使一氧化碳转化为二氧化碳;
④设样品中Fe2O3的质量为x,则
3CO+Fe2O3
2Fe+3CO2
160 112
x 5.6g
根据
=
解得x=8g
钛铁矿中Fe2O3的质量分数为:
×100%═80%
故答案为:(1)①低于;②Ag;单质;③致密的氧化膜;C3H8+5O2
3CO2+4H2O;隔离可燃物;
(2)①2CO+TiO2
Ti+2CO2;②用磁铁吸引;③通CO;排净装置内空气防止爆炸;将一氧化碳点燃转化为二氧化碳,防止污染环境;④80%.
②银具有辐射热量的作用,在家用热水瓶内胆壁具有保温作用,由于银的化学性质稳定,主要以单质的形式存在;
③铝与氧气反应生成氧化铝是一层致密的氧化膜,对内部起到保护作用;C3H8在空气中完全燃烧的反应物是C3H8和氧气,生成物是二氧化碳和水,先配平碳和氢,最后配平氧,反应条件是点燃,写在等号的上边;所以方程式是:C3H8+5O2
| ||
(2)①CO和TiO2反应的反应物是CO和TiO2生成物是Ti和CO2,用观察法配平,所以方程式是:2CO+TiO2
| ||
②因为磁铁能够吸引铁,而不能吸引其它金属,所以用磁铁吸引就行;
③实验前必须先通入一氧化碳,排净装置内空气,防止爆炸,由于一氧化碳有毒,排放到空气中污染空气,所以用酒精灯点燃,使一氧化碳转化为二氧化碳;
④设样品中Fe2O3的质量为x,则
3CO+Fe2O3
| ||
160 112
x 5.6g
根据
| 160 |
| 112 |
| X |
| 5.6g |
钛铁矿中Fe2O3的质量分数为:
| 8g |
| 10g |
故答案为:(1)①低于;②Ag;单质;③致密的氧化膜;C3H8+5O2
| ||
(2)①2CO+TiO2
| ||
点评:本题考查燃料的燃烧和一氧化碳还原矿石实验,在设计实验顺序上要注意坚持操作安全、环保的原则,先通一段时间一氧化碳是为了操作安全,先进性尾气处理是为了环保.

练习册系列答案
相关题目