题目内容
(6分)现有一包固体混合物A,可能含有NaCl、K2SO4、NaNO3、CuSO4、Na2CO3等五种物质中的一种或几种。取少量A作如下实验,现象如图所示(设过程中所能发生的反应都恰好完全进行)。
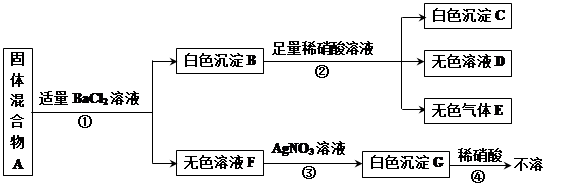
试根据实验过程和出现的现象做出判断,并填写以下空白:
(1)无色气体E是(写化学式) 。
(2)固体混合物A中一定存在物质是(写化学式) 。
(3)在溶液D中,肯定存在的酸根离子是(写离子符号)_____________。
(4)写出步骤③中发生的一个化学反应方程式 。
(5)固体混合物里,一定不存在的物质是(写化学式) ,得此结论的理由是________________________________________________。

试根据实验过程和出现的现象做出判断,并填写以下空白:
(1)无色气体E是(写化学式) 。
(2)固体混合物A中一定存在物质是(写化学式) 。
(3)在溶液D中,肯定存在的酸根离子是(写离子符号)_____________。
(4)写出步骤③中发生的一个化学反应方程式 。
(5)固体混合物里,一定不存在的物质是(写化学式) ,得此结论的理由是________________________________________________。
(1)CO2 (2) K2SO4 Na2CO3(3) NO3—
(4)NaCl+ AgNO3=AgCl↓+NaNO3或KCl+ AgNO3=AgCl↓+ KNO3
(5)CuSO4 因为F是无色溶液,所以原固体混合物中一定不存在CuSO4
(4)NaCl+ AgNO3=AgCl↓+NaNO3或KCl+ AgNO3=AgCl↓+ KNO3
(5)CuSO4 因为F是无色溶液,所以原固体混合物中一定不存在CuSO4
(1)根据溶液F是无色溶液,可以确定固体A中一定不含CuSO4;根据向白色沉淀B中滴加足量的稀硝酸时沉淀部分溶解,可以确定在固体A中一定含有K2SO4产生的硫酸钡沉淀,且同时产生气体,可以确定在固体A中一定含有Na2CO3,产生的气体就是碳酸钡沉淀与硝酸产生的二氧化碳气体;
(2)而向无色溶液F中滴加AgNO3溶液时产生白色沉淀G且不溶于稀硝酸,说明是氯化银沉淀,该白色沉淀却不能证明固体A中含有氯离子,原因是碳酸钠、硫酸钾都与氯化钡反应生成含氯离子的氯化钠或氯化钾,即使固体A中不含NaCl反应后溶液C中也会含有提供氯离子的物质;因此,固体A的可能含有NaCl,NaNO3也不能确定是否含有;
综上所述,固体A中一定不含有CuSO4;一定含有Na2CO3、K2SO4;可能含有NaCl、NaNO3;
(3)溶于D中的酸根离子来自硝酸与碳酸钡反应产生的硝酸钡中的硝酸根离子,即:NO3-;
(4)步骤③中产生的不是沉淀可能是氯化钠与硝酸银反应产生的,也可能是氯化钾和硝酸银反应产生的,故反应的方程式为:NaCl+AgNO3=AgCl↓+NaNO3或KCl+AgNO3=AgCl↓+KNO3;
(5)固体混合物中一定不含有硫酸铜,因为F是无色溶液,而硫酸铜的溶液是蓝色的,所以原固体混合物中一定不存在CuSO4
(2)而向无色溶液F中滴加AgNO3溶液时产生白色沉淀G且不溶于稀硝酸,说明是氯化银沉淀,该白色沉淀却不能证明固体A中含有氯离子,原因是碳酸钠、硫酸钾都与氯化钡反应生成含氯离子的氯化钠或氯化钾,即使固体A中不含NaCl反应后溶液C中也会含有提供氯离子的物质;因此,固体A的可能含有NaCl,NaNO3也不能确定是否含有;
综上所述,固体A中一定不含有CuSO4;一定含有Na2CO3、K2SO4;可能含有NaCl、NaNO3;
(3)溶于D中的酸根离子来自硝酸与碳酸钡反应产生的硝酸钡中的硝酸根离子,即:NO3-;
(4)步骤③中产生的不是沉淀可能是氯化钠与硝酸银反应产生的,也可能是氯化钾和硝酸银反应产生的,故反应的方程式为:NaCl+AgNO3=AgCl↓+NaNO3或KCl+AgNO3=AgCl↓+KNO3;
(5)固体混合物中一定不含有硫酸铜,因为F是无色溶液,而硫酸铜的溶液是蓝色的,所以原固体混合物中一定不存在CuSO4

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目