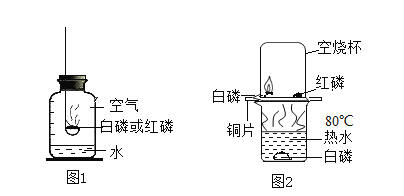
题目内容
【题目】某校化学活动小组的同学要测定菱铁矿石(主要成分FeCO3,杂质不含铁元素也不与酸发生反应,且不溶于水)的含量,小组同学取质量为40g的烧杯进行实验,过程如下。请回答下列问题:

(1)上述实验过程中发生的化学反应方程式为______。
(2)根据已知条件列出求解B烧杯中参加反应的物质质量为(x)的比例式______。
(3)实验中过滤得到的不溶物a值是______。
(4)样品中碳酸亚铁的含量是______。
(5)C烧杯中溶质的质量分数是______。
(6)若用该菱铁矿石来生产含铁96%的生铁,在冶炼过程中损失4%的铁元素,则580t该矿石能得到产品的质量是_____。
【答案】![]()
![]() 5.8 80% 12.7% 224t
5.8 80% 12.7% 224t
【解析】
碳酸亚铁和盐酸反应生成氯化亚铁、二氧化碳和水。
(1)上述实验过程中发生的反应是碳酸亚铁和盐酸反应生成氯化亚铁、二氧化碳和水,反应的化学反应方程式为![]() 。
。
(2)反应为碳酸亚铁和稀盐酸反应生成氯化亚铁、水和二氧化碳,反应的关系为
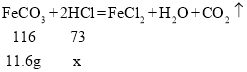
故B烧杯中参加反应的物质质量为(x)的比例式为![]() 。
。
(3)反应后得到一种溶质的溶液,所以盐酸完全反应。
设烧杯A中样品参加反应的碳酸亚铁质量为x,生成的氯化亚铁的质量为y,生成的二氧化碳的质量为z
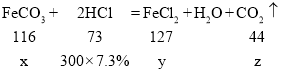
![]()
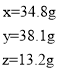
![]()
故实验中过滤得到的不溶物a值是5.8g。
(4)样品中碳酸亚铁的含量是![]() 。
。
(5)C烧杯中溶质的质量分数是![]() 。
。
(6)若用该菱铁矿石来生产含铁96%的生铁,在冶炼过程中损失4%的铁元素,则580t该矿石能得到产品的质量是![]() 。
。

 发散思维新课堂系列答案
发散思维新课堂系列答案【题目】小明在实验室发现一瓶未密封的KOH固体,对其成分进行实验探究。
[查阅资料]①KOH与NaOH的化学性质相似。请用化学方程式解释KOH变质的原因是_____。
②K2CO3溶液呈碱性,CaCl2溶液、KCl溶液量中性。
[猜想假设]假设I:只含KOH;假设Ⅱ:含KOH和K2CO3;假设用:只含K2CO3。
[进行实验]
实验操作步骤 | 实验现象 | 实验结论 |
(1)取少量样品于试管中,加入足量的稀盐酸 | 有气泡产生 | 假设_____不正确 |
(2)另取少量样品于试管中,加水溶解,加入过量的CaCl2溶液,振荡,静置 | _____。 | 假设Ⅱ正确 |
(3)取(2)中上层清液,滴加无色酚酞溶液 | _____。 |
[拓展应用](1)完全变质的KOH也有利用价值,从K2CO3的组成性质看, K2CO3在农业上的用途是_____(填一种即可)。
(2)通过上述实验探究,同学们向实验员提出了保存、使用易变质溶液的下列建议,其中合理的是_____ ( 填序号)。
A 使用前临时配制
B 禁止使用
C 密封保存
【题目】在研究酸和碱的化学性质时,某小组想证明稀硫酸和氢氧化钠溶液混合后,虽然无明显现象,但确实发生了化学反应。试与他们一起完成实验方案的设计、实施和评价,并得出有关结论。
(1)探究稀硫酸和氢氧化钠溶液的反应:
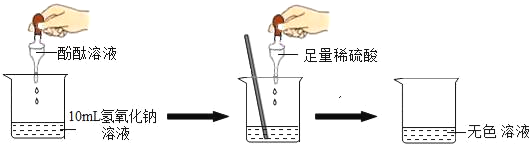
当滴入几滴酚酞试液后,溶液由无色变为_____色。根据上述实验中颜色变化,可确定稀硫酸和氢氧化钠溶液发生了化学反应,反应的化学方程式为:_____。
(2)探究上述稀硫酸和氢氧化钠溶液反应后烧杯中的硫酸是否过量:
根据上述反应过程中溶液变成无色,不能确定稀硫酸是否过量。同学们又分别选取氯化钡溶液、紫色石蕊试液设计实验方案,请你判断并
实验方案 | 实验步骤 | 实验现象 | 实验结论 |
方案一 | 取样,滴入适量的氯化钡溶液 | _____ | 稀硫酸过量 |
方案二 | 取样,滴入几滴紫色石蕊试液 | _____ | 稀硫酸过量 |
上述设计的实验方案中,正确的是_____(填“方案一”或“方案二”)。另外一个实验方案错误的原因是_____。若请你再设计一个确定稀硫酸是否过量的实验方案,你选用的药品是_____,实验现象及结论是_____。
【题目】下列各图是进行氧气、二氧化碳的实验室制取和有关性质的实验装置。
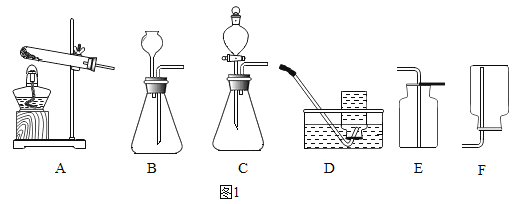
(1)图1某同学用A装置制氧气,写出该反应的化学方程式_______;若要制取一瓶二氧化碳,选用的装置为________。
(2)某化学兴趣小组的同学用图2所示的装置进行二氧化碳的性质实验(装置的气密性良好),先关闭止水夹,将足量的氢氧化钠滴入广口瓶中,充分反应后,再打开止水夹。
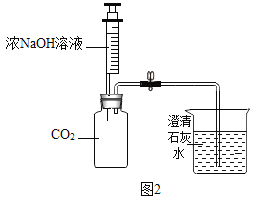
①广口瓶中观察到的现象__________。
②实验结束后,兴趣小组的同学提出新问题,广口瓶内液体的溶质可能是什么?
(猜想)
小亮:只有氢氧化钠;
小丽:氢氧化钠和氢氧化钙;
你的猜想:_______。
(探究与验证)
根据反应原理,该兴趣小组的甲、乙两位同学分别设计下列方案,对小组的猜想进行验证。实验操作、现象和结论如下表,请参与他们的探究并完成所缺内容。
实验操作 | 现象 | 结论 | |
甲 | 取少量广口瓶内液体,滴加几滴酚酞试液 | 溶液变红 | 小丽的猜想成立 |
乙 | 取少量广口瓶内液体,滴加_______(写一种盐溶液) | 产生白色沉淀 | 你的猜想成立 |
(反思与评价)
同学们认真研究实验流程,讨论后一致认为乙同学的方案合理。你认为甲同学设计的方案不合理的理由是
_________。