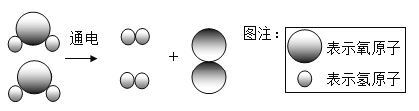
题目内容
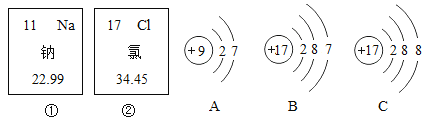
【题目】如图中的①、②分别是钠元素、氯元素在元素周期表中的信息,A、B、C是三种粒子的结构示意图。
试回答下列问题:
(1)画出钠原子的结构示意图______________。
(2)A、B、C中属于同种元素的粒子是_________。
(3)A和B两种粒子的_________________相同,所以它们具有相似的化学性质。
【答案】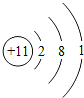 B、C 最外层电子数
B、C 最外层电子数
【解析】
(1)钠原子核内有11个质子,核外有3个电子层,第一层上有2个电子、第二层上有8个电子,最外层上有1个电子,其原子结构示意图为: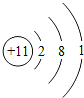 ;
;
(2)元素是质子数(即核电荷数)相同的一类原子的总称,同种元素的粒子是质子数相同,B、C的质子数相同,属于同种元素;
(3)元素的化学性质跟它的原子的最外层电子数目关系非常密切,最外层电子数相同的元素化学性质相似,A和B两种粒子的最外层电子数相同,所以它们具有相似的化学性质。

【题目】为测定某大理石样品中碳酸钙(杂质不溶于水也不参与反应)的质量分数,某小组的同学进行了如下实验(水和氯化氢的挥发忽略不计):取12.5g样品研碎放入烧杯中,每次加入20.8g稀盐酸后并用电子天平称量,记录实验数据如下。
加入稀盐酸次数 | 1 | 2 | 3 | 4 | 5 |
烧杯及所称物质总质量/g | 72.2 | 91.9 | 111.6 | 131.3 | 152.1 |
请计算:
⑴大理石样品中碳酸钙的质量分数;
⑵恰好完全反应时烧杯内溶液的溶质质量分数。
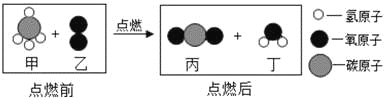
【题目】叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
(应用研究)
(1)汽车经撞击后,30毫秒内引发NaN3,迅速分解为Na、N2,反应方程式为_______。
(制备研究)
(2)将金属钠与液态氨反应得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和
气体X,该反应的化学方程式为2NaNH3+N2O = NaN3+NaOH+X,实验室检验X
气体使用的试纸是湿润________。
(Na2CO3质量分数测定)
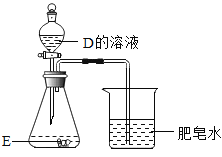
工业级NaN3中常含有少量的Na2CO3,为测定样品中Na2CO3的质量分数设计如图装置(已知H2SO4溶液与NaN3,反应不生成气体)。
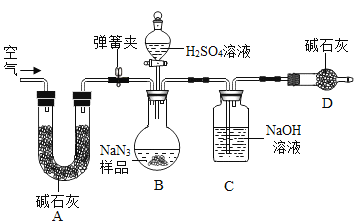
(3)装置A的作用是_____。设计的实验步骤为:①精确称量样品,检查装置气密性;②打开弹簧夹,鼓入空气,称量装置C;③关闭弹簧夹,打开分液漏斗活塞;④再打开弹簧夹,_______;⑤再次称量装置C。计算碳酸钠含量至少需要测定______(填数字)个数据。根据制备反应,分析工业级NaN3中含有Na2CO3的可能原因_______。
M |
(NaN3纯度测定)精确称量0.140 g NaN3样品,设计如图装置,测定其纯度。已知2 NaN3→ 3N2
(NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热。
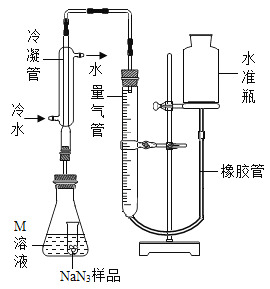
(4)检查该装置气密性的方法是连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差_____(填“变大”、“变小”或“不变”),说明气密性良好。
(5)使小试管中的NaN3样品与M溶液接触的操作是______。
(6)使用冷水冷凝的目的是______。反应前应将液面调节到量气管的“0”刻度,并使两边液面相平,反应后读数时,还需要进行的操作是_______。
(7)常温下测得量气管读数为67.2 mL(N2的密度为1.25 g/L),则实验中选用的量气管规格合适的是_____(填字母序号)。
A. 100 mL B. 1 L C. 2 L
(8)计算NaN3样品的纯度(写出计算过程)。
【题目】馒头、面包等发面食品的一个特点是面团中有许多小孔, 他们使发面食品松软可口。小明学习相关化学知识后, 将家里制作馒头用的白色粉末带到实验室与兴趣小组的同学一起进行探究。
(初步探究)取少量白色粉末于试管中, 加适量水, 测得溶液的 pH >7, 说明溶液呈________________性。
(提出问题)白色粉末成分是什么?
(查阅资料)
(1)碳酸钠、碳酸氢钠都可用于制作发面食品。
(2)碳酸氢钠不稳定, 受热易分解生成二氧化碳和水等; 碳酸钠很稳定。
(猜想与假设)
猜想Ⅰ: 碳酸钠
猜想Ⅱ: 碳酸氢钠
(实验探究)甲乙兴趣小组设计不同实验方案进行探究。
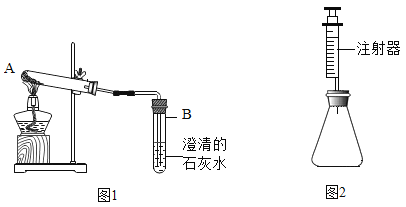
甲组方案: 如图 1取适量白色粉末于试管中, 将导管伸入澄清石灰水, 加热, 澄清石灰水变浑浊, 猜想Ⅱ正确。写出装置 B 中反应的化学方程式__________________。
乙组方案: 用如图 2 所示装置作为反应容器, 准确测量生成气体的体积以判断白色粉末的成分。分别向盛有碳酸钠、碳酸氢钠和白色粉末的锥形瓶中, 注入等体积、等浓度的足量的稀盐酸, 记录如表:
实验编号 | 锥形瓶内物质 | 最终得到 CO2 体积 /ml | |
名称 | 质量 /g | ||
① | 碳酸钠 | a | V1 |
② | 碳酸氢钠 | a | V2 |
③ | 白色粉末 | m | V3 |
实验②的化学反应方程式为______; 表中 m =____g;;根据上表中数据分析, 猜想Ⅱ正确,,判断的依据是____。
(反思应用)
(1)甲组方案中, 无法判断白色粉末是否为碳酸钠和碳酸氢钠的混合物; 乙组方案可以判断, 如果是两者的混合物, 应该满足的条件是______。
(2)家中制作馒头、面包时, 将面粉发酵 ( 产生有机酸) , 再加入适量的碳酸氢钠, 可以使馒头、面包松软。原因是_______。