题目内容
(2012?潍坊)“碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO2分离出来进行储存和利用的工艺和技术.
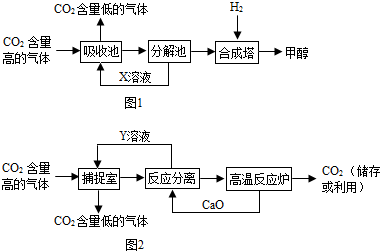
(1)最近有科学家提出“绿色自由”构想:把CO2含量高的气体吹入饱和K2CO3溶液中,生成KHCO3,然后利用KHCO3受热易分解的性质,再把CO2提取出来,经化学反应使之变为甲醇(CH3OH)和水.“绿色自由”构想的技术流程如图1:
(注:分解池内的反应条件是加热;合成塔内的反应条件为300℃、200kPa和催化剂)
①分解池内反应的化学方程式为
②合成塔内反应的化学方程式为
③X溶液可循环利用,溶质是
(2)实际生产中,经常利用NaOH溶液来“捕捉”CO2,流程图如图2(部分条件及物质未标出).
①捕捉室内反应的化学方程式为
②“反应分离”发生反应的化学方程式为
③该生产过程中,涉及到的物质属于碱的是

(1)最近有科学家提出“绿色自由”构想:把CO2含量高的气体吹入饱和K2CO3溶液中,生成KHCO3,然后利用KHCO3受热易分解的性质,再把CO2提取出来,经化学反应使之变为甲醇(CH3OH)和水.“绿色自由”构想的技术流程如图1:
(注:分解池内的反应条件是加热;合成塔内的反应条件为300℃、200kPa和催化剂)
①分解池内反应的化学方程式为
2KHC03
K2C03+H20+C02↑
| ||
2KHC03
K2C03+H20+C02↑
;
| ||
②合成塔内反应的化学方程式为
3H2+CO2
CH30H+H20
| ||
| 催化剂 |
3H2+CO2
CH30H+H20
;
| ||
| 催化剂 |
③X溶液可循环利用,溶质是
K2C03
K2C03
(填写化学式).(2)实际生产中,经常利用NaOH溶液来“捕捉”CO2,流程图如图2(部分条件及物质未标出).
①捕捉室内反应的化学方程式为
C02+2NaOH=Na2C03+H20
C02+2NaOH=Na2C03+H20
.②“反应分离”发生反应的化学方程式为
CaO+H20=Ca(OH)2,Ca(OH)2+Na2C03=CaC03↓+2NaOH
CaO+H20=Ca(OH)2,Ca(OH)2+Na2C03=CaC03↓+2NaOH
.③该生产过程中,涉及到的物质属于碱的是
Ca(OH)2、NaOH
Ca(OH)2、NaOH
(填写化学式).分析:(1)结合反应流程图分析化学反应的反应物、生成物和反应条件,并据此书写方程式;
①分解池内发生的反应是碳酸氢钾分解生成碳酸钾、水和二氧化碳;
②观图示,合成塔内反应是氢气与二氧化碳反应生成甲醇和水;
③由分解池分解后所得溶液X可通入吸收池再利用,其主要成分是碳酸钾;
(2)①根据反应物、生成物以及质量守恒定律写出方程式;
②根据图示信息和反应关系分析解答;
③根据碱的组成特点进行分析:碱是由金属元素和氢氧根离子组成的化合物.
①分解池内发生的反应是碳酸氢钾分解生成碳酸钾、水和二氧化碳;
②观图示,合成塔内反应是氢气与二氧化碳反应生成甲醇和水;
③由分解池分解后所得溶液X可通入吸收池再利用,其主要成分是碳酸钾;
(2)①根据反应物、生成物以及质量守恒定律写出方程式;
②根据图示信息和反应关系分析解答;
③根据碱的组成特点进行分析:碱是由金属元素和氢氧根离子组成的化合物.
解答:解:(1)①由反应流程图可知:在分解池内发生的反应是碳酸氢钾分解生成碳酸钾、水和二氧化碳,方程式是2KHC03
K2C03+H20+C02↑;故答案为:2KHC03
K2C03+H20+C02↑;
②观图示,合成塔内反应是氢气与二氧化碳反应生成甲醇和水,反应条件是300℃、200kPa和催化剂,方程式是3H2+CO2
CH30H+H20;故答案为:3H2+CO2
CH30H+H20;
③由分解池分解后所得溶液X可通入吸收池再利用,可以确定其主要成分是碳酸钾;
故答案为:K2C03;
(2)①二氧化碳和氢氧化钠反应生成碳酸钠和水,所以捕捉室内反应的化学方程式为:C02+2NaOH=Na2C03+H20;
故答案为:C02+2NaOH=Na2C03+H20;
②由题意可知,在捕捉室内吸收二氧化碳的溶液是氢氧化钠溶液,分离室中加入氧化钙和Y溶液可以生成氢氧化钠溶液;氧化钙可与水反应生成氢氧化钙,而氢氧化钙与碳酸钠溶液反应可生成氢氧化钠溶液和碳酸钙沉淀;故在反应分离室内发生的反应是生石灰与水、氢氧化钙与碳酸钠的反应;
故答案为:CaO+H20=Ca(OH)2,Ca(OH)2+Na2C03=CaC03↓+2NaOH;
③碱是由金属元素和氢氧根离子组成的化合物,该生成过程中,氢氧化钙与氢氧化钠属于碱;
故答案为:Ca(OH)2、NaOH.
| ||
| ||
②观图示,合成塔内反应是氢气与二氧化碳反应生成甲醇和水,反应条件是300℃、200kPa和催化剂,方程式是3H2+CO2
| ||
| 催化剂 |
| ||
| 催化剂 |
③由分解池分解后所得溶液X可通入吸收池再利用,可以确定其主要成分是碳酸钾;
故答案为:K2C03;
(2)①二氧化碳和氢氧化钠反应生成碳酸钠和水,所以捕捉室内反应的化学方程式为:C02+2NaOH=Na2C03+H20;
故答案为:C02+2NaOH=Na2C03+H20;
②由题意可知,在捕捉室内吸收二氧化碳的溶液是氢氧化钠溶液,分离室中加入氧化钙和Y溶液可以生成氢氧化钠溶液;氧化钙可与水反应生成氢氧化钙,而氢氧化钙与碳酸钠溶液反应可生成氢氧化钠溶液和碳酸钙沉淀;故在反应分离室内发生的反应是生石灰与水、氢氧化钙与碳酸钠的反应;
故答案为:CaO+H20=Ca(OH)2,Ca(OH)2+Na2C03=CaC03↓+2NaOH;
③碱是由金属元素和氢氧根离子组成的化合物,该生成过程中,氢氧化钙与氢氧化钠属于碱;
故答案为:Ca(OH)2、NaOH.
点评:本题考查了学生分析图示及书写方程式的能力,解题时首先要根据流程图明确物质的制备过程,才能确定发生的化学反应,从而写出反应的方程式;该类题能很好的考查学生分析、解决问题的能力.

练习册系列答案
相关题目