题目内容
【题目】现有一定量的NaHCO3固体,将其加热一段时间后得13.7g固体,将固体加水充分溶解,得无色透明溶液,再向其中加入100g7.3%稀盐酸,充分反应后,所得溶液恰好为中性,请计算在加热过程中分解了的NaHCO3得占原固体中NaHCO3的质量分数为(NaHCO3受热分解生成Na2CO3、H2O、CO2)( )
A. 50% B. 60% C. 70% D. 80%
【答案】A
【解析】
设原碳酸氢钠的质量为x,根据:2NaHCO3![]() Na2CO3+H2O+CO2↑,Na2CO3+2HCl=2NaCl+H2O+CO2↑,NaHCO3+HCl=NaCl+H2O+CO2↑,一系列的反应可得碳酸氢钠与盐酸反应的关系式:
Na2CO3+H2O+CO2↑,Na2CO3+2HCl=2NaCl+H2O+CO2↑,NaHCO3+HCl=NaCl+H2O+CO2↑,一系列的反应可得碳酸氢钠与盐酸反应的关系式:
NaHCO3~ HCl
8436.5
x100g×7.3%
![]() =
=![]() 解得x=16.8g,此为原固体中碳酸氢钠的质量。
解得x=16.8g,此为原固体中碳酸氢钠的质量。
设分解的碳酸氢钠的质量为y,将碳酸氢钠加热一段时间后得13.7g固体,可得反应前后固体质量差为3.1g。
2NaHCO3![]() Na2CO3+H2O+CO2↑ 固体质量差
Na2CO3+H2O+CO2↑ 固体质量差
168 62
y 3.1g
![]() =
=![]() 解得y=8.4g,此为分解的碳酸氢钠的质量。故在加热过程中分解了得NaHCO3得占原固体中NaHCO3得质量分数=
解得y=8.4g,此为分解的碳酸氢钠的质量。故在加热过程中分解了得NaHCO3得占原固体中NaHCO3得质量分数=![]() ×100%=50%。故本题选择A。
×100%=50%。故本题选择A。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案【题目】某校研究性学习小组的同学设计了一个对比实验,探究物质溶于水时是放出热量还是吸收热量。向下图A、B、C三个实验装置中盛有一定量水的小试管里依次加入固体NaCl、NH4NO3、NaOH(加入固体物质之前,三个实验装置中U形管两端的液面持平)。
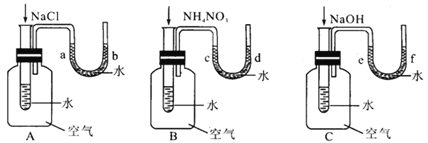
(1)请你帮他们填写下表。
A | B | C | |
现象 | ___________ | ____________ | ___________ |
原因 | __________ | ____________ | ____________ |
(2)从上述物质溶解于水的对比实验中你得出的初步结论是______________。